
【题目】A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中:C元素的原子最外层电子数是次外层电子数的三倍;A与D、C与F同主族;D是所在周期原子半径最大的主族元素,又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素D在周期表中的位置________________。
(2)写出B单质的电子式________________。
(3)C、D、F三种元素形成的简单离子的半径由大到小的顺序是________(用离子符号表示)。
(4)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有_________________________。
(5)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:__________________________________________________________。
若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:_______________________________________________。
(6)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方程式_________________________________________________________。
(7)写出由A和D形成的化合物与水反应的化学方程式_____________________。
【答案】 第三周期第ⅠA族 ![]() S2->O2->Na+ 离子键、共价键 2Al+Fe2O3
S2->O2->Na+ 离子键、共价键 2Al+Fe2O3![]() Al2O3+2Fe SiO2+2OH-===SiO
Al2O3+2Fe SiO2+2OH-===SiO![]() +H2O 2SO2+O2+2H2O===2H2SO4 NaH + H2O=== NaOH+ H2
+H2O 2SO2+O2+2H2O===2H2SO4 NaH + H2O=== NaOH+ H2
【解析】C元素的原子最外层电子数是次外层电子数的三倍,且是短周期元素,所以C是O元素,C与F同主族,且是短周期元素,所以F是S元素,D与E和F同周期,都处于第三周期,且D是所在周期原子半径最大的主族元素,所以D是Na元素,E的原子序数大于钠小于硫,所以E的单质是固体,六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,B的原子序数小于C,且B、C处于同一周期,所以B是N元素,A的单质是气体,则A的原子序数最小,所以A是H元素。
(1)D是Na元素,钠原子核外有3个电子层,最外层有1个电子,所以其在元素周期表中的位置是第三周期第IA族,故答案为:第三周期第IA族;
(2)氮气分子中氮原子间形成三键,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)电子层数越多,离子半径越大,电子层结构相同的离子,离子半径随着原子序数的增大而减小,所以C、D、F三种元素形成的简单离子的半径由大到小的顺序是S 2->O 2->Na+,故答案为:S 2->O 2->Na+;
(4)由A、B、C三种元素以原子个数比4:2:3形成化合物X为NH4NO3,硝酸铵中所含化学键类型有离子键和共价键,故答案为:离子键、共价键;
(5)若E是金属元素,则为Al元素,铝和氧化铁能发生铝热反应,反应方程式为:2Al+Fe2O3![]() Al2O3+2Fe,若E是非金属元素,其单质在电子工业中有重要应用,则E是Si元素,二氧化硅和强碱反应生成硅酸盐和水,离子反应方程式为:SiO2+2OH-=SiO3 2-+H2O,故答案为:2Al+Fe2O3
Al2O3+2Fe,若E是非金属元素,其单质在电子工业中有重要应用,则E是Si元素,二氧化硅和强碱反应生成硅酸盐和水,离子反应方程式为:SiO2+2OH-=SiO3 2-+H2O,故答案为:2Al+Fe2O3![]() Al2O3+2Fe,SiO2+2OH-=SiO3 2-+H2O;
Al2O3+2Fe,SiO2+2OH-=SiO3 2-+H2O;
(6)SO2气体有毒,且有还原性,二氧化硫和水反应生成亚硫酸,亚硫酸易被氧气氧化生成硫酸,所以该反应的方程式为:2SO2+O2+2H2O=2H2SO4,故答案为:2SO2+O2+2H2O=2H2SO4;
(7)由A和D形成的化合物为NaH,与水反应的化学方程式为NaH + H2O=== NaOH+ H2,故答案为:NaH + H2O=== NaOH+ H2。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是一种化学电源,以多孔金属为电极,氢氧化钾溶液为电解质溶液,装置如图所示。下列说法不正确的是

A. 电流从电极A流向电极B
B. 反应前后氢氧化钾溶液的pH降低
C. 通氧气的电极反应式:O2+4e-+2H2O=4OH-
D. 电池工作时,正负极均不产生燃烧现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酸(CH2=CH-COOH)的性质时可能有
①加成反应;②聚合反应,③酯化反应;④中和反应;⑤氧化反应
A. 只有①③ B. 只有①③④ C. 只有①③④⑤ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用硫酸废渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)并回收(NH4)2SO4,具体生产流程如图所示:
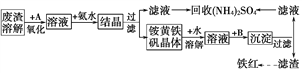
注:铵黄铁矾的化学式为(NH4)2Fe6(SO4)4(OH)12
回答下列问题:
(1)在废渣溶解操作中,加速废渣溶解的措施有________。
(2)物质A是一种氧化剂。
①工业上物质A最好选用________(填序号)。
A.空气 B.Cl2 C.MnO2 D.KMnO4
②简述工业上这样选择A的理由:__________________________________。
③写出A参与反应的离子方程式:__________________________________。
(3)往铵黄铁矾溶液(含Fe3+)中加入溶液B至pH为5时产生沉淀,请写出产生沉淀的离子方程式:__________________________________。
(4)回收所得的(NH4)2SO4晶体中可能含有的杂质是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 离子化合物中可能含有共价键 B. 化学键是分子间强烈的作用力
C. H、D、 T表示三种氢元素 D. 共价化合物中各原子都一定满足最外层8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是有关物质相互转化的关系图,其中A俗称铁红,甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀,I的颜色呈浅绿色.
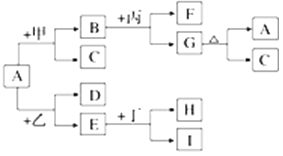
(1)若F是由Na+和SO42﹣组成的溶液,则甲的化学式是______________,列举A物质的一种用途__________________________.
(2)若D是能使澄清石灰水变浑浊的气体,则乙的化学式为________,丁属于单质、酸、碱中的________;在I溶液中加入氢氧化钠溶液,可以观察到的现象是_______________,对应的离子方程式和化学方程式依次是___________________________________________.
(3)写出G→A+C的化学方程式:______________________________________.
(4)写出E和C反应的方程式并用单线桥法标明电子的转移方向和数目:____________.
(5)若A中混有杂质Al2O3,除去杂质的方法是加入过量的_________,该反应的离子方程式为________________________________________________.
(6)由E和A组成的混合物与稀H2SO4作用,固体恰好溶解,所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为4:1.则反应物中A、E、H2SO4的物质的量之比为_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数,下列说法中正确的是
A. 常温、常压下,32 g O2和O3混合气体中含有2NA个原子
B. 常温下,5.6 g铁粉加入足量浓硝酸中反应,转移的电子数为0.3NA
C. 1 L 0.5 mol·L-1Na2CO3溶液中,阴阳离子总数为1.5NA
D. 16 g CH4与18 g NH![]() 所含质子数相等
所含质子数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com