
| A. | 能量变化是化学反应的基本特征之一 | |
| B. | 需加热的化学反应未必都是吸热反应 | |
| C. | 化学反应中的能量变化只与反应物的状态有关与其质量无关 | |
| D. | 石墨转化为金刚石是吸热反应说明金刚石总能量更高 |
分析 A、化学反应的过程是旧键断裂和新键形成的过程,断键需要吸收能量,成键能够释放能量;
B、反应热与反应条件无关,决定于反应物和生成物能量的相对大小;
C、能量变化的大小与反应物的质量成正比;
D、石墨转化为金刚石是吸热反应,说明石墨能量比金刚石低.
解答 解:A、化学反应的过程是旧键断裂和新键形成的过程,断键需要吸收能量,成键能够释放能量,所以,任何化学反应都伴随着能量变化,故A正确;
B、可燃物的燃烧都是放热反应,但需要加热到着火点,故B正确;
C、能量变化的大小与反应物的质量成正比,故C错误;
D、石墨转化为金刚石是吸热反应,说明石墨能量比金刚石低,则金刚石总能量更高,故D正确;
故选C.
点评 本题考查化学反应中能量变化的实质、形式和影响因素,难度不大.


科目:高中化学 来源: 题型:解答题
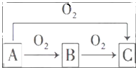 A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去):
A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去):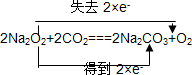 ,并用双线桥法表示上述反应中电子转移的方向和数目,如此反应转移0.5mol电子时,生成物中气体在标准状况下的体积为5.6L.如在AlCl3溶液中投入足量的(1)中的C物质,则反应的离子方程式为2Na2O2+Al3+═AlO2-+O2↑+4Na+.
,并用双线桥法表示上述反应中电子转移的方向和数目,如此反应转移0.5mol电子时,生成物中气体在标准状况下的体积为5.6L.如在AlCl3溶液中投入足量的(1)中的C物质,则反应的离子方程式为2Na2O2+Al3+═AlO2-+O2↑+4Na+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 | |
| B. | Na2SO3溶液中:c(H+)+c(HSO3-)+c(H2SO3)═c(OH-) | |
| C. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| D. | 向含有AgCl固体的溶液中加入适量水使AgCl溶解又达到平衡时,在该温度下AgCl的溶度积不变,其溶解度也不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{22.4N}{V}$ mol-1 | B. | $\frac{VN}{22.4}$mol-1 | C. | $\frac{VN}{11.2}$ mol-1 | D. | $\frac{11.2N}{V}$ mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加甲基橙显黄色的溶液:Na+、NO3-、SO32-、Fe3+ | |
| B. | 加入Al粉能放出H2的溶液:Al3+、NO3-、HCO3-、Ba2+ | |
| C. | c(OH -)水=1×10-12的溶液:K+、NH4+、Cl -、SO42- | |
| D. | 能使pH试纸显深红色的溶液:Fe 2+、Cl -、Ba 2+、ClO - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在2L密闭容器中进行反应3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H>0测得n(H2O)随反应时间(t)的变化如图所示.下列判断正确的是( )
在2L密闭容器中进行反应3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H>0测得n(H2O)随反应时间(t)的变化如图所示.下列判断正确的是( )| A. | 该反应的化学平衡常数表达式为K=c4(H2O)/c4(H2) | |
| B. | 5min时该反应的υ(正)等于9min时的υ(逆) | |
| C. | 0~5min内,υ(H2)=0.10mol/(L•min) | |
| D. | 10min时平衡发生移动可能是投入还原性铁粉引起 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 称为“现代有机合成之父”的伍德沃德曾组织14个国家的110位化学家,协同攻关,探索维生素B12的结构,其结构如图对此结构的下列说法中,正确的是( )
称为“现代有机合成之父”的伍德沃德曾组织14个国家的110位化学家,协同攻关,探索维生素B12的结构,其结构如图对此结构的下列说法中,正确的是( )| A. | 维生素B12属于有机物 | B. | 维生素B12属于无机物 | ||
| C. | 维生素B12属于烃 | D. | 维生素B12属于芳香族化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
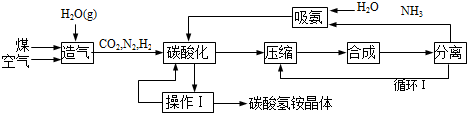

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com