
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:分析 (1)根据中和热的测定原理结合装置图判断;
(2)中和热测定实验成败的关键是保温工作,大烧杯上如不盖硬纸板,热量损失较多;
(3)反应放出的热量和所用酸以及碱的量的多少有关,根据中和热的概念和实质来回答;
(4)NH3•H2O电离过程中会吸热.
解答 解:(1)中和热测定实验成败的关键是保温工作,内外烧杯为一样高,否则,热量散失大,由装置图可知缺少环形玻璃搅拌棒,碎纸片未填充满大烧杯与小烧杯之间的空隙;
故答案为:少环形玻璃搅拌器;烧杯上移与硬纸板接触;碎纸片未填充满;
(2)中和热测定实验成败的关键是保温工作,大烧杯上如不盖硬纸板,热量损失较多,测定的热量的值偏小,所以求得的中和热数值偏小;
故答案为:偏小;
(3)反应放出的热量和所用酸以及碱的量的多少有关,若用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,生成水的物质的量增多,所放出的热量偏高,但中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关,中和热数值相等,即不变;
故答案为:不相等;相等;因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关;
(4)NH3•H2O电离过程中会吸热,所以相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小;
故答案为:偏小.
点评 本题考查了中和热的测定方法,题目难度不大,注意掌握测定中和热的正确方法,明确实验操作过程中关键在于尽可能减少热量散失,使测定结果更加准确.


科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,18g H2O 中含有的原子总数无法计算 | |
| B. | 在标准状况时,20mL NH3 与60mL O2所含的分子个数比为1:3 | |
| C. | 将80g NaOH 溶于1L水中,所得溶液中NaOH 的物质的量浓度为2 mol•L-1 | |
| D. | 1L 0.25mol/L H2SO4 溶液中含有6.02×1023个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na | B. | FeCl3溶液 | C. | KMnO4酸性溶液 | D. | 溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCOOH+H2O?HCOO-+H3O+ | B. | CO32-+H2O?HCO3-+OH- | ||
| C. | CO2+H2O?HCO3-+H+ | D. | HS-?S2-+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用浓盐酸与MnO2反应制Cl2,每生成22.4 LCl2,转移的电子总数为2NA | |
| B. | 1 mol O2在反应中作氧化剂时,所得电子数一定为4NA | |
| C. | 1 mol Na2O2与足量H2O反应,转移电子数为2NA | |
| D. | 0.1 mol金属钠在过量氧气中充分燃烧,生成的化合物中离子总数为0.15NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
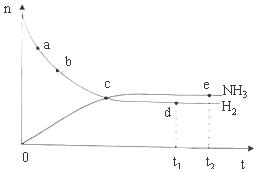 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的小 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 点d(t1时刻)和点e(t2时刻)处H2的转化率相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com