


科目:高中化学 来源: 题型:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2molNH3 | 4molNH3 |
| NH3的浓度(mol?L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
| A、c1=c2 |
| B、a+b=92.4 |
| C、2p2=p3 |
| D、α2>α3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠在Cl2中燃烧,产生大量黄烟 |
| B、HClO是弱酸,所以NaCIO是弱电解质 |
| C、Cl2通入H2S饱和溶液中出现浑浊,说明氧化性:Cl2>S |
| D、新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、b>a>m |
| B、m>b>a |
| C、a>m>b |
| D、a>b>m |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| A、体系的压强不再发生变化 |
| B、生成nmolCO的同时生成n molH2 |
| C、v正(CO)=v逆(H2O) |
| D、1molH-H键断裂的同时2molH-O键断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
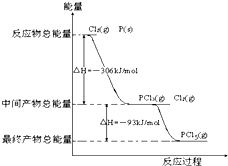 红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据),根据图回答下列问题:
红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据),根据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2、Na2O均能吸收CO2并放出氧气 |
| B、CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| C、Na比Cu活泼,将Na投入CuSO4溶液中会有铜析出 |
| D、从lL lmol?L-1的H2SO4溶液中取出10 mL,其中H+浓度为2mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com