
A、B、C、D、E、F、G、L、I九种主族元素分别位于三个不同的短周期,它们的原子序数依次增大,其中B、C、D位于同一周期,A与E、B与G、D与L分别位于同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F最外层电子数的2倍,C和D的最外层电子数之和为11。请回答下列问题:
(1)以上元素中非金属所形成的最简单气态氢化物稳定性最弱的是(填化学式)__________________________,E、F、L所形成的简单离子的半径由大到小的顺序为(用离子符号表示)____________。
(2)L、I两元素可按原子个数比1∶1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为__________________________________________。
(3)固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生,写出该反应的离子方程式:_______________________。
(4)由A、B、C、D按原子个数比4∶1∶1∶2形成一种化合物Y,则Y的化学式为________________________,向Y中加足量稀硫酸后,再加高锰酸钾溶液,高锰酸钾溶液褪色。写出使高锰酸钾溶液褪色的反应的离子方程式:____________________________。
答案 (1)SiH4 S2->Na+>Al3+
(2) 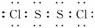
(3)Na2O2+S2-+2H2O===S↓+2Na++4OH-
(4)(NH4)2C2O4 2MnO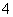 +5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
解析 由于九种主族元素位于三个不同的周期,而B、C、D位于同一周期,可以知道A为氢元素,B、C、D位于第2周期,E、F、G、L、I则位于第3周期;由A与E为同一主族元素,可确定E为钠元素;由F的质子数比D多5,D的最外层电子数是F最外层电子数的2倍,可推知D、F为氧元素和铝元素;由C、D、F三种元素的原子序数之和为28,可推知C元素为氮元素;由D与L位于同一主族,可推知L为硫元素;由其原子序数关系和B与G位于同一主族可知,I只能是氯元素,B、G分别为碳元素和硅元素。即A、B、C、D、E、F、G、L、I分别对应H、C(碳)、N、O、Na、Al、Si、S、Cl。(1)题述非金属元素除H外,C(碳)、N、O、Si、S、Cl中硅元素的非金属性最弱,故形成的最简单的气态氢化物中SiH4的稳定性最弱。E、F、L所形成的简单离子中S2-与氩原子的核外电子排布相同,而Na+和Al3+则与氖原子核外电子排布相同,故离子半径大小顺序为S2->Na+>Al3+。(2)L、I两元素按原子个数比1∶1组成的化合物应该是S2Cl2,其中硫原子和硫原子之间、硫原子和氯原子之间均以共价单键的形式结合。(3)Na2O2和Na2S的水溶液发生氧化还原反应,生成NaOH,同时有S沉淀析出。(4)由A、B、C、D按原子个数比4∶1∶1∶2形成的化合物为(NH4)2C2O4。C2O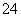 具有还原性,能够被酸性KMnO4溶液氧化,反应的离子方程式为2MnO
具有还原性,能够被酸性KMnO4溶液氧化,反应的离子方程式为2MnO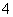 +5H2C2O4+6H+===2Mn2++10CO2↑+8H2O。
+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O。


科目:高中化学 来源: 题型:
有A、B、C三种晶体,分别由H、C、Na、Cl四种元素中的一种或几种组成,对这三种晶体进行实验,结果如表:
| 序号 | 熔点/℃ | 硬度 | 水溶性 | 导电性 | 水溶液与Ag+反应 |
| A | 811 | 较大 | 易溶 | 水溶液或熔融导电 | 白色沉淀 |
| B | 3 500 | 很大 | 不溶 | 不导电 | 不反应 |
| C | -114.2 | 很小 | 易溶 | 液态不导电 | 白色沉淀 |
(1)晶体的化学式分别为A______________、B________________、C____________。
(2)晶体的类型分别是A______________、B_________________、C____________。
(3)晶体中微粒间作用力分别是A________、B__________________、C________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)有5种单核粒子,它们分别是 □、
□、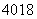 □、
□、 □+、
□+、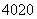 □2+、
□2+、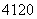 □(“□”内元素符号未写出),则它们所属元素的种类有______种。
□(“□”内元素符号未写出),则它们所属元素的种类有______种。
(2)1H、2H、3H三种微粒都属于________,因为它们是具有相同______________的同一类原子。
(3)在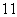 H、
H、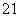 H、
H、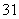 H、
H、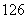 C、
C、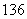 C、
C、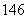 C、
C、 N、
N、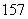 N中,核素、元素的种数分别为______种、______种。
N中,核素、元素的种数分别为______种、______种。
(4)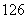 C、
C、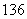 C、
C、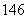 C的关系为__________,因为它们是具有____________________的同一元素的不同原子。其化学性质几乎完全相同。
C的关系为__________,因为它们是具有____________________的同一元素的不同原子。其化学性质几乎完全相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
在陆地生态系统研究中,2H、13C、15N、18O、34S等常用作环境分析指示物。下列说法正确的是( )
A.34S原子核内中子数为16
B.16O2比18O2沸点更低
C.2H+的酸性比1H+的酸性更强
D.13C和15N原子核内的质子数相差2
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z均为短周期主族元素,其核电荷数依次增大,且它们的原子最外层电子数之比为1∶4∶2。下列叙述中正确的是( )
A.X一定是碱金属元素
B.Y元素能形成化合物NaHYO3,且其水溶液呈碱性
C.Z元素形成的最高价氧化物熔点较低
D.X的单质一定能通过电解Z的盐酸盐溶液制备
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.甲苯是饱和烃,氯乙烯是不饱和烃
B.石油的裂化产品能使溴水褪色
C.蛋白质在CuSO4溶液中发生盐析
D.油脂在NaOH溶液中水解生成高级脂肪酸和甘油
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关有机物性质的说法正确的是( )
A.蛋白质可以与酸、碱或重金属盐反应
B.芳香烃都不能使酸性KMnO4溶液褪色
C.CH3CH2OH与氢溴酸能反应
D.石油的分馏可获得乙烯、丙烯等不饱和烃
查看答案和解析>>
科目:高中化学 来源: 题型:
在室温条件下,向含有H2SO4的CuSO4溶液中逐滴加入含a mol溶质的NaOH溶液,恰好使溶液的pH=7,下列叙述正确的是( )
A.溶液中c(Na+)=2c(SO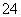 )
)
B.0<沉淀的物质的量<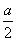 mol
mol
C.沉淀的物质的量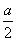 mol
mol
D.原溶液中c(H2SO4)=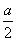 mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO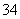 +2I-+2H+AsO
+2I-+2H+AsO +I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40% NaOH溶液。
+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40% NaOH溶液。

下列叙述中正确的是( )
A.甲组操作时,电流计(G)指针发生偏转
B.甲组操作时,溶液颜色变浅
C.乙组操作时,C2作正极
D.乙组操作时,C1上发生的电极反应为I2+2e-===2I-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com