
下列叙述中不正确的是( )
A、电解池的阳极发生氧化反应,阴极发生还原反应
B、原电池跟电解池连接后,电子从原电池负极流向电解池阳极
C、电镀时,电镀池里的阳极材料发生氧化反应
D、电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
“低碳生活”是指生活作息时所耗用能量要减少,从而降低碳特别是二氧化碳的排放。下列行为不利于低碳生活的是
A.处理废弃塑料制品较为合理的方法是使用化学方法加工成防水涂料或汽油
B.开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料
C.实现资源的“3R”,即:减少消耗(Reduce)、增加重复使用(Reuse)、重复再生(Recycle)
D.逐步推广天然气,代替石油和煤的使用
查看答案和解析>>
科目:高中化学 来源: 题型:
目前,我国已经具备了大力推广燃料乙醇的基本条件,部分城市已在汽油中添加燃料乙醇。下列对于乙醇作为燃料的叙述中,错误的是( )
A.乙醇处于半氧化态(耗氧量比汽油少),不需改造发动机便可实现零污染排放
B.使用燃料乙醇可以综合解决国家石油短缺、粮食过剩及环境恶化三大热点问题
C.乙醇的整个生产和消费过程可形成无污染和洁净的闭路循环过程,属可再生能源
D.使用燃料乙醇对抑制“温室效应”意义重大,因此燃料乙醇也属于“清洁燃料”
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下图所示的原电池,下列说法正确的是( )

A、电子从锌电极通过检流计流向铜电极
B、盐桥中的阴离子向硫酸铜溶液中迁移
C、锌电极发生还原反应,铜电极发生氧化反应
D、铜电极上发生的电极反应是:2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于原电池的叙述中,正确的是( )
A.原电池能将化学能转变为电能
B.原电池负极发生的电极反应是还原反应
C.原电池在工作时其正极不断产生电子并经外电路流向负极
D.原电池的电极只能由两种不同的金属构成
查看答案和解析>>
科目:高中化学 来源: 题型:
普通干电池两极材料是锌和石墨棒,两极间为MnO2、NH4Cl、ZnCl2糊状物,下列说法错误的是( )
A.干电池中锌作负极,石墨棒作正极
B.负极发生还原反应:Zn-2e-====Zn2+
C.MnO2的作用是把正极附近生成的氢气氧化成水,避免氢气泡出现
D.干电池工作时,由化学能转变为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
KMnO4溶液常用做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此精确配制KMnO4标准溶液的操作是:
(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸l h;
(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;
(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处:
(4)利用氧化还原滴定方法,在70℃-80℃条件下用基准试剂(纯度高、稳定性好的物质如:草酸)溶液测定其浓度。
回答下列问题:
(1)为什么要称取稍多于所需的KMnO4固体? 。
(2)通常使用的酸性高锰酸钾溶液,是在高锰酸钾溶液滴入 (填试剂名称)使溶液呈酸性。
(3)若准确称取W g草酸晶体(H2C2O4·2H2O)溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液V mL。
①配制高锰酸钾溶液必须用到的玻璃仪器除了烧杯和玻璃棒外还有
②写出滴定过程中对应的离子方程式
KMnO4溶液的物质的量浓度为________________mol/L;
③若滴定前平视,滴定后俯视,则测得的浓度值将________(填“偏高”或“偏低”)
④达到滴定终点的现象为
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为________。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是________(填序号)。
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液 NaClO3溶液
NaClO3溶液 KClO3晶体①完成Ⅰ中反应的总化学方程式:
KClO3晶体①完成Ⅰ中反应的总化学方程式:
 NaCl+
NaCl+ H2O===
H2O=== NaClO3+
NaClO3+ ________。
________。
②Ⅱ中转化的基本反应类型是________________,该反应过程能析出KClO3晶体而无其他晶体析出的原因是____________________________________。
(4)一定条件下,在水溶液中1 mol Cl-、ClO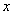 (x=1,2,3,4)的能量(kJ)相对大小如右图所示。
(x=1,2,3,4)的能量(kJ)相对大小如右图所示。
①D是________(填离子符号)。
②B→A+C反应的热化学方程式为________________(用离子符号表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com