
【题目】氮化镁(Mg3N2)是一种高强度钢冶炼的添加剂,现某学习小组利用下列装置制备少量氮化镁。
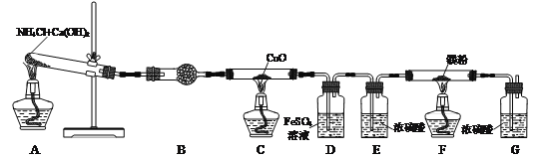
已知:Ⅰ.3Mg+N2![]() Mg3N2;Ⅱ.Mg3N2+6H2O=3Mg(OH)2+2NH3↑
Mg3N2;Ⅱ.Mg3N2+6H2O=3Mg(OH)2+2NH3↑
(1)检查该装置气密性的方法是___。
(2)写出装置A中发生反应的化学方程式:___,装置B中试剂的名称是___。
(3)反应一段时间后装置C中黑色固体变为红色,并有水珠出现。装置C中发生反应的化学方程式为___。
(4)装置D中FeSO4溶液的作用是___。
(5)实验过程中装置A和F应该先加热的是___处。
(6)装置F中有氮化镁生成,写出通过实验验证氮化镁生成的操作及现象:取少量装置F反应后的固体于试管中,___,说明其中含氮化镁。
【答案】在装置A处微微加热,G处出现气泡,(停止微热后,G中导管内出现一段水柱) Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+H2O 碱石灰 3CuO+2NH3
CaCl2+2NH3↑+H2O 碱石灰 3CuO+2NH3![]() 3Cu+N2+3H2O 吸收装置中的O2,以免O2与Mg发生反应 A 加入少量水,微热,用湿润的红色石蕊试纸于试管口检验所得气体,若气体变蓝
3Cu+N2+3H2O 吸收装置中的O2,以免O2与Mg发生反应 A 加入少量水,微热,用湿润的红色石蕊试纸于试管口检验所得气体,若气体变蓝
【解析】
(1)用加热法检查该装置气密性;
(2)装置A中氯化铵和氢氧化钙在加热条件下生成氯化钙、氨气、水;装置B的作用是除去氨气中的水蒸气;
(3)反应一段时间后装置C中黑色氧化铜固体变为红色,并有水珠出现,说明氨气与氧化铜反应生成铜、氮气、水;
(4)FeSO4具有还原性,能吸收空气中的氧气;
(5)为防止氧气与镁反应,应先通一段时间的氨气,排出装置中的空气;
(6)根据Mg3N2+6H2O=3Mg(OH)2+2NH3↑,检验Mg3N2的存在。
(1). 在装置A处微微加热,G处出现气泡,停止微热后,G中导管内出现一段水柱,说明装置气密性良好;
(2)装置A中氯化铵和氢氧化钙在加热条件下生成氯化钙、氨气、水,反应方程式是Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+H2O;装置B的作用是除去氨气中的水蒸气,装置B中试剂的名称是碱石灰;
CaCl2+2NH3↑+H2O;装置B的作用是除去氨气中的水蒸气,装置B中试剂的名称是碱石灰;
(3)反应一段时间后装置C中黑色氧化铜固体变为红色,并有水珠出现,说明氨气与氧化铜反应生成铜、氮气、水,反应方程式是3CuO+2NH3![]() 3Cu+N2+3H2O;
3Cu+N2+3H2O;
(4)FeSO4具有还原性,能吸收空气中的氧气,装置D中FeSO4溶液的作用是吸收装置中的O2,以免O2与Mg发生反应;
(5)为防止氧气与镁反应,应先通一段时间的氨气,排出装置中的空气,所以应该先加热的是A处;
(6)Mg3N2+6H2O=3Mg(OH)2+2NH3↑,验证氮化镁生成的操作及现象:取少量装置F反应后的固体于试管中,加入少量水,微热,用湿润的红色石蕊试纸于试管口检验所得气体,若气体变蓝,说明其中含氮化镁。


 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,近年来,人们对这些颜料的成分进行了研究,发现其成分主要为BaCuSi4O10、BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均有Cun+离子,n=___________,基态时该阳离子的价电子排布式为___________。
(2)“中国蓝”的发色中心是以Cun+为中心离子的配位化合物,其中提供孤对电子的是____元素。
(3)已知Cu、Zn的第二电离能分别为1957.9kJ·mol-1、1733.3kJ·mol-1,前者高于后者的原因是________________________________________。
(4)铜常用作有机反应的催化剂。例如,2CH3CH2OH+O2![]() 2CH3CHO+2H2O。乙醛分子中碳原子的杂化轨道类型是___________;乙醛分子中σ键与π键的个数比为___________。
2CH3CHO+2H2O。乙醛分子中碳原子的杂化轨道类型是___________;乙醛分子中σ键与π键的个数比为___________。
(5)铜的晶胞如图所示。铜银合金是优质的金属材料,其晶胞与铜晶胞类似,银位于顶点,铜位于面心。

①该铜银合金的化学式是___________________。
②已知:该铜银晶胞参数为acm,晶体密度为ρg·cm-3。
则阿伏加德罗常数(NA)为_______mol-1(用代数式表示,下同)。
③若Ag、Cu原子半径分别为bcm、ccm,则该晶胞中原子空间利用率φ为___________。(提示:晶胞中原子空间利用率=![]() ×100%)
×100%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个1.0 L的恒容密闭容器中分别进行反应2X(g)+Y(g)![]() Z(g) ΔH,达到平衡。相关数据如下表。
Z(g) ΔH,达到平衡。相关数据如下表。
容器 | 温度/K | 物质的起始浓度/ mol·L-1 | 物质的平衡浓度/ mol·L-1 | ||
c(X) | c(Y) | c(Z) | c(Z) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | a |
III | 500 | 0.20 | 0.10 | 0 | 0.025 |
下列说法不正确的是
A. 平衡时,X的转化率:II>I
B. 平衡常数:K(II)>K(I)
C. 达到平衡所需时间:III<I
D. 反应的ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气已成为城市空气的主要污染源之一,其中的氮氧化物是重要污染物。
(1)汽车内燃机工作时产生NO的原理如图1所示:

该反应的热化学方程式为______。
(2)治理尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0。若在一定温度下将2mol NO、1mol CO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图2所示。
N2(g)+2CO2(g) ΔH<0。若在一定温度下将2mol NO、1mol CO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图2所示。
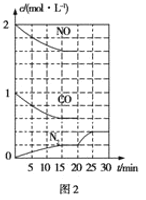
①则从开始到达到平衡状态的过程中,平均反应速率υ(CO2)=____,该温度下反应的平衡常数K=____(结果保留两位有效数字)
②20min时改变的条件可能是____
A.增大压强 C.减小CO2浓度且改用更高效的催化剂
B.降低温度 D.在恒温恒容条件下,充入He气体
③若保持温度不变,20min时向容器中充入CO、N2各0.6mol,平衡将____(填“正向”“逆向”或“不”)移动。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,向1L密闭容器中加入不同物质的量的NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压强的关系如图3所示。
N2(g)+2CO2(g),在恒温条件下,向1L密闭容器中加入不同物质的量的NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压强的关系如图3所示。
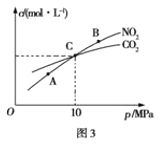
①下列不能说明该反应已达到平衡状态的是_____
a.C的质量不变 b. 混合气体的密度不再发生改变
c. v正(N2)=υ逆(CO2) d.混合气体的颜色不再改变
②计算C点时该反应的平衡常数Kp(C)=___(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.9g水中含有的原子总数为1.5×6.02×1023
B.1.0mol·L-1氯化镁溶液中含有Cl-数为2.0×6.02×1023
C.标准状况下,11.2L四氯化碳中含有的分子数为0.5×6.02×1023
D.钠与水反应时,每反应0.1mol钠,转移电子数为0.2×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“冰面为什么滑?”,这与冰层表面的结构有关(如图)。下列有关说法错误的是

A.由于氢键的存在,水分子的稳定性好,高温下也很难分解
B.第一层固态冰中,水分子间通过氢键形成空间网状结构
C.第二层“准液体”中,水分子间形成氢键的机会比固态冰中少
D.当高于一定温度时,“准液体”中的水分子与下层冰连接的氢键断裂,产生“流动性的水分子”,使冰面变滑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某测定O2含量的传感器工作原理如图所示。O2通过聚四氟乙烯膜进入传感器只与AlI3反应生成Al2O3和I2,RbAg4I5固体只传导Ag+,E为电位计。下列说法错误的是
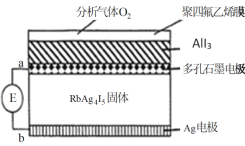
A.电子由a极移动到b极
B.RbAg4I5质量不发生变化
C.b极的电极反应式为:Ag+I--e-=AgI
D.该传感器协同总反应方程式为:3O2+4AlI3+12Ag=2Al2O3+12AgI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁和铝的合金投入100 mL,一定物质的量浓度的盐酸中,恰好反应,共产生气体5.6 L(标准状况下),向所得溶液中滴加5mol·L-1NaOH溶液至过量,最终产生白色沉淀13.6 g。请计算:
(1)原合金中镁和铝的质量分别是________。
(2)原盐酸溶液的物质的量浓度________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸在有机化工中有广泛的用途,工业上可有多种途径来制备甲酸。回答下列问题:
(1)利用光催化制甲酸原理如图所示。
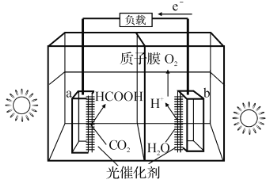
该装置能量转化方式为___。
(2)另一种以Ru化合物为催化剂,用H2和CO2制取甲酸的反应机理如下:
第一步:Ru(OH)2+2H2RuH2+2H2O 快速平衡
第二步:RuH2+2CO2→Ru(OOCH)2 慢反应(近似认为不影响第一步反应的平衡)
第三步:Ru(OOCH)2+2H2O→2HCOOH+Ru(OH)2 快反应
下列表述正确的是___ (填序号)。
A.平衡时v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有Ru(OOCH)2
C.第二步反应中RuH2与CO2的碰撞仅部分有效
D.第三步反应的活化能较低
(3)CO2加氢也可制备甲酸(HCOOH)。
①工业上利用甲酸的能量关系转换图如图:
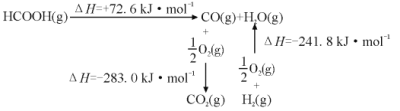
反应CO2(g)+H2(g) HCOOH(g)的焓变△H=___kJ·mol-1。
②温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g) HCOOH(g) K=2
实验测得:v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=___(以k正表示)。
③当温度改变为T2℃时,k正=1.9k逆,则T2℃时平衡压强___T1℃时平衡压强(填“>”“<”或“=”),理由是___。
(4)甲酸是唯一能和烯烃发生加成反应的羧酸,目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。
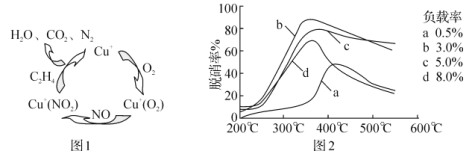
①写出该脱硝原理总反应的化学方程式:___。
②为达到最佳脱硝效果,应采取的条件是___。
(5)T℃,甲酸与醋酸钠溶液反应:HCOOH+CH3COO- HCOO-+CH3COOH,该反应的平衡常数为12.5,则该温度下醋酸的电离常数Ka(CH3COOH)=___(T℃时甲酸的电离常数为2×10-4)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com