
分析 (1)若C为氯化钠,D能使澄清石灰水变浑浊的无味气体,应为CO2,若A为无氧酸,可为NaHCO3或Na2CO3与盐酸的反应;
(2)若A为某浓溶液,C、D均为气体,其中C可以使品红褪色即为SO2,可为浓硫酸与碳的反应;
(3)若A、C、D均含有氯元素,且A的化合价介于C与D之间,常见反应为氯气和氢氧化钠的反应;
(4)若A为Al,D为NO,可为铝与稀硝酸反应生成硝酸铝、NO和H2O;
(5)若A为具有磁性的黑色固体即Fe3O4,B为无氧酸即HCl,C和D含有的元素种类相同,可为Fe3O4与HCl反应生成氯化铁、氯化亚铁和水.
解答 解:(1)若C为氯化钠,D能使澄清石灰水变浑浊的无味气体,应为CO2,若A为无氧酸,可为NaHCO3或Na2CO3与盐酸的反应,则A是HCl,B可能是NaHCO3或Na2CO3,故答案为:NaHCO3;Na2CO3;
(3)若A为某浓溶液,C、D均为气体,其中C可以使品红褪色即为SO2,可为浓硫酸与碳反应生成二氧化硫、二氧化碳和水,则A为浓硫酸,C为CO2,故答案为:浓硫酸;CO2;
(3)若A、C、D均含有氯元素,且A的化合价介于C与D之间,常见反应为氯气和氢氧化钠的反应,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)若A为Al,D为NO,可为铝与稀硝酸反应生成硝酸铝、NO和H2O,反应的化学方程式为Al+4HNO3=Al(NO3)3+NO↑+2H2O,故答案为:Al+4HNO3=Al(NO3)3+NO↑+2H2O;
(5)若A为具有磁性的黑色固体即Fe3O4,B为无氧酸即HCl,C和D含有的元素种类相同,可为Fe3O4与HCl反应生成氯化铁、氯化亚铁和水,反应的化学方程式为Fe3O4+8HCl=2FeCl3+FeCl2+4H2O,
故答案为:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O.
点评 本题综合考查无机物的推断,全面考查学生的分析能力和元素化合物知识的综合运用,为高频考点,注意相关基础知识的积累,牢固把握元素化合物知识为解答该题的关键,难度中等.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯与浓溴水在铁做催化剂的条件下制备溴苯 | |
| B. | H2N-CH2-COOH, , ,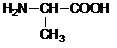 三种氨基酸脱水缩合,最多生成6种二肽 三种氨基酸脱水缩合,最多生成6种二肽 | |
| C. |  与氢氧化钠醇溶液共热,可得2种产物 与氢氧化钠醇溶液共热,可得2种产物 | |
| D. | 分子式为C5H12O的有机物,能与Na反应放出氢气的结构有8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量 | |
| B. | 雾霾可能是许多细小液体小液滴和固体小颗粒分散到空气中形成的一种胶体 | |
| C. | 铝制餐具不宜用来蒸煮或长时间存放咸的食品 | |
| D. | 在食品袋中放入CaCl2•6H2O,可防止食物受潮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24 L气体是NO | |
| B. | 反应后Fe全部转化为Fe3+ | |
| C. | 反应后的溶液中c(NO3-)=1.7 mol•L-1 | |
| D. | 反应后的溶液最多还能再溶解2.24 g Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 磷及其化合物在生产生活中的用途非常广泛.回答下列问题:
磷及其化合物在生产生活中的用途非常广泛.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
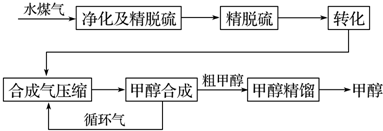
| 物质 | H2 | CO | CH3OH |
| 浓度/mol•L-1 | 0.2 | 0.1 | 0.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com