
将CO2慢慢通入一定体积的NaOH溶液中,溶液的pH随CO2体积(标准状况下)的变化曲线如图所示,则下列说法中正确的是( )
A.NaOH溶液的物质的量浓度为0.1 mol/L,体积为1 L。
B.M、N点离子浓度的都是c(HCO3- )>c(CO32 -)。
C.V=3.36 L时,溶液中的离子浓度关系是
c(Na+)>c(HCO3- )>c(CO32 -)>c(OH-)>c(H+)。
D.曲线上任意点都符合:
c(Na+)+c(H+)=c(CO32 -)+c(HCO3- )+c(OH-)。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列关于溶液和胶体的叙述,正确的是
A.溶液是电中性的,胶体是带电的
B.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
C.溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动
D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有
查看答案和解析>>
科目:高中化学 来源: 题型:
能说明元素X原子的得电子能力强于元素Y原子的得电子能力的事实是
)。
A.元素周期表中元素X位于元素Y的上一周期
B.元素X的含氧酸的酸性强于元素Y的含氧酸的酸性
C.分别加热H2X、HY至500 ℃,只有HY发生分解
D.元素X与Y同主族,相同温度时其单质与铜反应分别生成Cu2X和CuY
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C5H12O的饱和一元醇与和它相对分子质量相同的饱和一元羧酸进行酯化反应,生成的酯共有(不考虑立体异构)
A.13种 B.14种 C.15种 D.16种
查看答案和解析>>
科目:高中化学 来源: 题型:
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的______区;溴的价电子排布式为________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是_________(写出名称)。
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
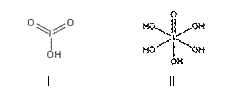 (4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图I、II所示:
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图I、II所示:
请比较二者酸性强弱:HIO3_____ H5IO6(填“>”、 “<”或“=”)。
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
 (6)右图为碘晶体晶胞结构。有关说法中正确的是_________。
(6)右图为碘晶体晶胞结构。有关说法中正确的是_________。
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子
以4配位数交替配位形成层结构
 B.用均摊法可知平均每个晶胞中有4个碘原子
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
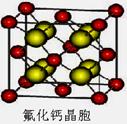
(7)已知CaF2晶体(见右图)的密度为ρg/cm3,NA为阿伏
加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的
相对分子质量可以表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Fe2+和I-是两种常见的还原性离子。
(1)向FeSO4溶液中滴加氯水,溶液由浅绿色变成黄色,反应的离子方程式为__________________(2分);
向KI溶液中滴加氯水,溶液由无色变成黄色,反应的离子方程式为______________________ (2分)。
(2)请以FeSO4溶液、KI溶液、氯水为试剂探究Fe2+和I-的还原性强弱。
①提出假设:假设1:Fe2+还原性强于I-;假设2:_____________________________(1分)
②设计实验方案,写出实验步骤、预期现象和结论。其他限选试剂:3 mol·L-1 H2SO4、0.01 mol·L-1 KMnO4、20% KSCN、3%H2O2、淀粉溶液、紫色石蕊溶液。
| 实验步骤(6分) | 预期现象与结论(2分) |
| 步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再_________ __ | 现象:溶液变成黄色。结论:可能是生成了Fe3+、也可能是生成了I2。 |
| 步骤2:___________________________
|
|
(3)利用(2)②中提供的试剂证明碘与铁的化合物中铁显+2价,实验操作和现象是:
取少量样品溶于水,______________________________________________________。(3分)
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应:A===B+C在室温下不能自发进行,在高温下能自发进行,对该反应过程ΔH、ΔS的判断正确的是( )
A.ΔH<0、ΔS<0 B.ΔH>0、ΔS<0
C.ΔH<0、ΔS>0 D.ΔH>0、ΔS>0
查看答案和解析>>
科目:高中化学 来源: 题型:
H2O2是一种绿色氧化还原试剂,写出H2O2分解反应方程式并标明电子转移的方向和数目:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.同温同压下,H2(g)+Cl2(g)====2HCl(g)在光照和点燃的条件下ΔH不同
B.常温下,反应CaCO3(s)====CaO(s)+CO2(g)不能自发进行,则该反应的ΔH>0
C.某反应低温条件下能够自发进行,则高温条件下一定能够自发
D.KNO3溶于水的过程熵值减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com