
���� ��1����C��ʯī��+O2 ��g���TCO2��g������H1=-394 kJ•mol-1
��C��ʯī��+$\frac{1}{2}$O2 ��g���TCO ��g������H2=-111 kJ•mol-1
��H2��g��+$\frac{1}{2}$O2 ��g���TH2O��g������H3=-242kJ•mol-1
���ݸ�˹���ɣ���-��-�۵õ���CO��g��+H2O��g��=CO2��g��+H2��g�����ݴ˼��㣻
��2���ٸ�������ʽ���ⷨ�������Ӧ���������Ũ�ȵı仯����ƽ��ʱ����ֵ�Ũ�ȣ�����ƽ�ⳣ������ʽ����ƽ�ⳣ����
�ڼ����ʱ�̷�Ӧ��Ũ����Qc��Ȼ����ƽ�ⳣ���Ƚ��жϷ�Ӧ���з���
�����ڸ÷�ӦΪ���ȷ�Ӧ������������£�ƽ�⽫������Ӧ�����ƶ���ƽ�ⳣ��������¶�Խ�ͷ�Ӧ����ԽС���ݴ˴��⣮
��� �⣺��1����C��ʯī��+O2 ��g���TCO2��g������H1=-394 kJ•mol-1
��C��ʯī��+$\frac{1}{2}$O2 ��g���TCO ��g������H2=-111 kJ•mol-1
��H2��g��+$\frac{1}{2}$O2 ��g���TH2O��g������H3=-242kJ•mol-1
���ݸ�˹���ɣ���-��-�۵õ���CO��g��+H2O��g��=CO2��g��+H2��g��������H=��H1-��H2-��H3=-394 kJ•mol-1+111 kJ•mol-1+242kJ•mol-1=-41kJ•mol-1��
�ʴ�Ϊ��-41��
��2����ƽ��ʱCO��ת����Ϊ60%����CO��Ũ�ȱ仯��=2mol/L��60%=1.2mol/L����
CO��g��+H2O��g��?CO2��g��+H2��g��
��ʼ��mol/L����2 3 ���� 0 0
�仯��mol/L����1.2 �� 1.2 ������ 1.2 1.2
ƽ�⣨mol/L����0.8 1.8 ���� 1.2 1.2
��ƽ�ⳣ��K=$\frac{1.2��1.2}{0.8��1.8}$=1��
�ʴ�Ϊ��1��
������ͬ�¶��£�850�棩������ʼʱc��H2O��=2mol•L-1��c��CO��=1mol•L-1����Ӧ����һ��ʱ����H2��Ũ��Ϊ0.5 mol•L-1��
���ʱc��CO2��=0.5mol•L-1��c��H2O��=1.5mol•L-1��c��CO��=0.5mol•L-1��
���ݷ�Ӧ CO��g��+H2O��g���TCO2��g��+H2 ��g����Ũ����Qc=$\frac{0.5��0.5}{1.5��0.5}$=$\frac{1}{3}$��1����ƽ��������Ӧ���У���ʱv��������v���棩��
�ʴ�Ϊ�����ڣ�Qc=$\frac{1}{3}$��K=1��
�����ڸ÷�ӦΪ���ȷ�Ӧ������������£�ƽ�⽫������Ӧ�����ƶ���ƽ�ⳣ��������¶�Խ�ͷ�Ӧ����ԽС�����Է�Ӧ���ʽ���С��
�ʴ�Ϊ������С��
���� ���⿼���˸�˹���ɵ�Ӧ�á���ѧƽ�ⳣ����Ӱ�����ء�Ӱ�컯ѧƽ������ء���ѧƽ��ļ���ȣ��Ѷ��еȣ�ע�������������ʽ���⣮


 ��Կ���Ծ�ϵ�д�
��Կ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C3H8 | B�� | C3H4 | C�� | C2H2 | D�� | C3H6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH4$\stackrel{����}{��}$C+2H2 | |
| B�� | CH3CH=CH2+Br2$\stackrel{CCl_{4}}{��}$CH3CHBrCH2Br | |
| C�� | CH+2O2$\stackrel{��ȼ}{��}$CO2+2H2O | |
| D�� | CH4+Cl2$\stackrel{��}{��}$CH3Cl+HCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ԣ�HCl04��HBr04��HI04 | B�� | ���ԣ�Na0H��Mg��0H��2��Al��0H��3 | ||
| C�� | �ȶ��ԣ�PH3��H2S��HCl | D�� | �ǽ����ԣ�F��0��S |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
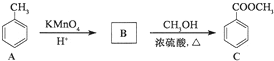
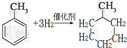 ����Ӧ����Ϊ�ӳɷ�Ӧ��
����Ӧ����Ϊ�ӳɷ�Ӧ��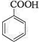 ������B�Ĵֲ�Ʒͨ�����ؽᾧ�ķ����ᴿ��
������B�Ĵֲ�Ʒͨ�����ؽᾧ�ķ����ᴿ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
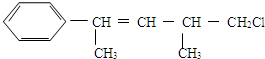
| A�� | ����ʹ����KMnO4��Һ��ɫ | |
| B�� | ��ʹ��ˮ��ɫ | |
| C�� | �ڼ��Ⱥʹ��������£�����ܺ�4 molH2��Ӧ | |
| D�� | һ�������£��ܷ���ȡ����Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ʵ����������� | ʵ����� | |
| A | ��SO2ͨ��Ʒ����Һ�У���ɫ����ȥ���ټ�������ɫ����Һ����Һ�ָֻ�Ϊ��ɫ | ���ɵ�������ȶ� |
| B | ��ij����Һ�м���ŨNaOH��Һ�����ȣ�����������ʹʪ��ĺ�ɫʯ����ֽ����ɫ | ԭ��Һ�к���NH+4 |
| C | ��ij��������Һ�м�������ϡH2SO4���ữ���ٵμӼ���KSCN��Һ����Һ���ɫ | ԭ������ΪFe��NO3��3 |
| D | ������Һ��ϡ�������ȣ�һ��ʱ������������Һ����ˮ�ܼ��ȣ��Թ��ڱ�δ�������� | ����һ����δˮ�� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��E��H�����������ŵ����Ʒֱ����ǻ���̼̼˫����
��E��H�����������ŵ����Ʒֱ����ǻ���̼̼˫���� +CH3CH2OH$��_{��}^{Ũ����}$
+CH3CH2OH$��_{��}^{Ũ����}$ +H2O��n
+H2O��n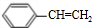 $\stackrel{����}{��}$
$\stackrel{����}{��}$ ��
�� ��д������һ�ֵĽṹ��ʽ����
��д������һ�ֵĽṹ��ʽ�����鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com