
在密闭容器中,当合成氨的反应N2+3H2===2NH3(正反应是放热反应)达到平衡时,改变如下的一些条件:
(A)升温,(B)加压,(C)减压,(D)增大c(H2),(E)减小c(NH3),(F)增大c(NH3),若平衡向右移动用“ →”,若平衡向左移动用“←”表示;若值增加用“↑”表示,若值减小用“↓”表示,请根据下表中各项的变化情况,在改变条件栏目中填上相应的编号(每项只改变一个条件)。
| 编号 | 改变条件 | 平衡移动方向 | N2的转化率 | C(NH3) | C(N2) | C(H2) |
| ① | → | ↑ | ↓ | ↓ | ↓ | |
| ② | ← | ↓ | ↓ | ↑ | ↑ | |
| ③ | → | ↑ | ↑ | ↓ | ↑ | |
| ④ | ← | ↓ | ↓ | ↓ | ↓ | |
| ⑤ | → | ↑ | ↑ | ↑ | ↑ |
科目:高中化学 来源: 题型:阅读理解
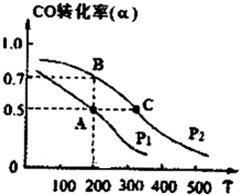 (2013?淄博一模)请运用化学反应原理的相关知识研究元素及其化合物的性质.
(2013?淄博一模)请运用化学反应原理的相关知识研究元素及其化合物的性质.| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
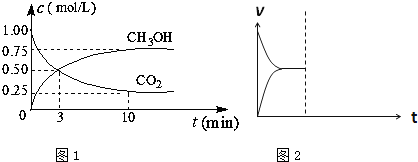
| 催化剂 |
| 温度/k CO2转化率% |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省扬州市邗江区高二下学期期中考试化学试卷(带解析) 题型:填空题
(14分)CO2可转化成有机物实现碳循环。
(1)在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 mol·L-1,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 mol·L-1,测得CO2和CH3OH(g)的浓度随时间变化如图所示。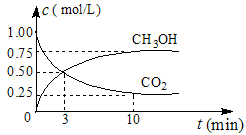
①从0 min到10 min,v(H2)= mol·(L·min)-1。
②能说明上述反应达到平衡状态的是 (选填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1︰1(即图中交叉点)
B.容器内气体的压强不随时间的变化而变化
C.单位时间内每消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
③下列措施中能使n (CH3OH)/n (CO2)增大的是 (选填编号)。
A.将H2O(g)从体系中分离 B.恒温恒容充入He
C.恒温恒压充入He D.恒温恒容再充入1 mol CO2和3 mol H2
(2)据报道,一定条件下由二氧化碳和氢气合成二甲醚已成为现实。
2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
在一定压强下,测得反应的实验数据如下表。
分析表中数据回答下列问题:
①反应的温度升高,K值 (填“增大”、“减小”或“不变”)。
②提高氢碳比[n(H2)/n(CO2)], K值 (填“增大”、“减小”或“不变”)。
(3)800℃时,C(s)+CO2(g) 2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向 (填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向 (填“正”或“逆”)方向进行。
(4)在密闭容器中通入1mol H2和1mol CO2发生H2(g)+CO2(g)  CO(g)+H2O(g) △H> 0反应,当反应达到平衡后,在其他条件不变时,若升高温度,请在下图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图。
CO(g)+H2O(g) △H> 0反应,当反应达到平衡后,在其他条件不变时,若升高温度,请在下图中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图。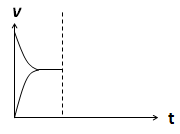
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(13分)光气学名“碳酰氯”,化学式COCl2,是窒息性毒剂之一。
2-1 光气化学性质活泼,具有酰卤的典型反应,易发生水解、氨解和醇解。
(1)光气与足量乙醇反应所得产物的化学名称是 ;
(2)光气与足量氨气反应的化学方程式 ;
(3)足量苯在AlCl3催化剂作用下与光气反应所得产物的结构简式 ;
(4)光气与苯胺分两步反应可得异氰酸苯酯,中间产物的结构简式是 ,异氰酸苯酯的结构简式是 。
2-2 实验室可用四氯化碳和发烟硫酸(H2SO4?SO3)反应制备光气,写出化学方程式。
2-3 BTC是一种稳定的白色结晶体,熔点为78~82℃,沸点为203~206℃。1mol BTC可在一定条件下分解产生3mol光气,所以又被称为“三光气”。工业上可以利用碳酸二甲酯的氯代反应制备BTC。BTC的反应活性与光气类似,可以和醇、醛、胺、酰胺、羧酸、酚、羟胺等多种化合物反应,因此低毒性的BTC在化学反应中完全可替代剧毒(被禁用)的光气合成相关的化工产品。
(1)BTC分子中所有氯原子都等价,试写出结构简式
(2)除毒性外,BTC比光气还有什么优点?
2-4 2004年6月15日福建省物质结构研究所(简称物构所)一下属企业,因实验操作不当造成有毒光气泄漏。造成1人死亡,260多人送医院救治。光气遇热按照下式分解:COCl2(g)=CO(g)+Cl2(g),Kp=4.44×10-2(668K,K为标准平衡常数),在密闭容器中,当混合气体总压力为300kPa时,计算该混合气体的平均分子量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com