
| A. | 原子半径:Na>Si>Cl | B. | 还原性:Na>Mg>Al | ||
| C. | 稳定性:SiH4>H2S>HCl | D. | 酸性:H3PO4<H2SO4<HClO4 |
分析 A.同周期从左向右原子半径在减小;
B.同周期从左向右金属性减弱;
C.非金属性越强,则气态氢化物越稳定;
D.非金属性越强,则最高价氧化物的水化物的酸性越强.
解答 解:A.同周期从左向右原子半径在减小,则Na>Si>Cl,故A正确;
B.同周期从左向右金属性减弱,则还原性Na>Mg>Al,故B正确;
C.非金属性Cl>S>Si,则气态氢化物稳定性为HCl>H2S>SiH4,故C错误;
D.非金属性Cl>S>P,则最高价氧化物的水化物的酸性为HClO4>H2SO4>H3PO4,故D正确;
故选C.
点评 本题考查元素周期表和元素周期律,熟悉同周期、同主族元素的性质变化规律即可解答,难度不大.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 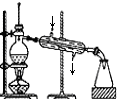 海水蒸馏得到淡水 | |
| B. | 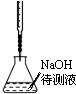 中和滴定 | |
| C. | 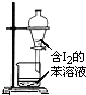 苯萃取碘水中I2,分出水层后的操作 | |
| D. | 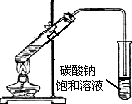 制备乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业合成氨 | |
| B. | 雷雨天,空气中的氮气转化为能被植物吸收的硝酸盐 | |
| C. | 用氨气与硝酸制成“硝铵”化肥 | |
| D. | 豆科作物的根瘤菌将空气中的氮转化为氨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
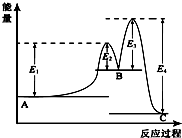
| A. | A?B的反应热△H=+(E2-E1)KJ/mol | |
| B. | 三种化合物中A最稳定 | |
| C. | C?B是放热反应 | |
| D. | 催化剂是要参与化学反应的,使用合适的催化剂可以降低反应所需要的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
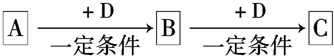
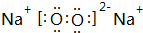 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
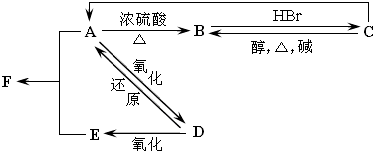
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 75%的酒精溶液 | B. | 硝酸钠 | C. | 碱石灰 | D. | 豆浆 | ||||
| E. | 过氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
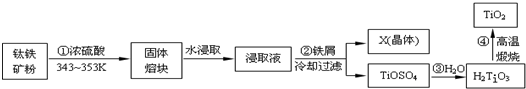
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com