
强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O (l) △H=-57.3 KJ·mol-1。分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀硝酸;③稀醋酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是( )
A.△H1>△H2>△H3 B.△H1<△H2<△H3
C.△H1>△H2=△H3 D.△H1=△H2<△H3
科目:高中化学 来源:2016-2017学年江西省高二上期中理化学卷(解析版) 题型:选择题
实验室用标准盐酸测定某NaOH溶液的浓度,用甲基橙作指示剂,下列对测定结果评价错误的是
选项 | 操作 | 测定结果评价 |
A | 酸式滴定管在装液前未用标准盐酸润洗2~3次 | 偏高 |
B | 开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 | 偏高 |
C | 锥形瓶未干燥 | 无影响 |
D | 盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 | 偏低 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团二师华山中学高一期中化学卷(解析版) 题型:选择题
下列叙述正确的是
A.1 L水中溶解了40 g NaOH后,所得溶液浓度为1 mol/L
B.从1 L 2 mol/L的NaCl溶液中取出0.5 L,该溶液的浓度为1 mol/L
C.将2.24 L(标准状况)HCl气体溶于水制成100 mL溶液,其物质的量浓度为1 mol/L
D.配制1 L 0.2 mol/L的CuSO4溶液,需用32g胆矾
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团二师华山中学高二期中化学卷(解析版) 题型:填空题
对于A+2B(气) nC(气)在一定条件下达到平衡后,改变下列条件,请回答:
nC(气)在一定条件下达到平衡后,改变下列条件,请回答:
(1)A量的增加或减少,平衡不移动,则A为_________态。
(2)增压,平衡不移动,当n=2时,A的状态为___________;当n=3时,A的状态为_________。
(3)若A为固体,增大压强,C的组分含量减少,则n的取值范围___________。
(4)升温,平衡向右移动,则该反应的逆反应为___________反应。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆兵团二师华山中学高二期中化学卷(解析版) 题型:选择题
将4 m ol A气体和2 mol B气体在2L 的容器中混合发生如下反应:2A(g)+B(g)
ol A气体和2 mol B气体在2L 的容器中混合发生如下反应:2A(g)+B(g)  2C(g)若经2s 后测得C的浓度为0.6mol•L-1现有下列几种说法其中不正确的是( )
2C(g)若经2s 后测得C的浓度为0.6mol•L-1现有下列几种说法其中不正确的是( )
A. 用物质A表示的反应的平均速率为0.3 mol•L-1•s-1
B. 2s时的压强是起始时的1.1倍
C.  2s时物质A的转化率为30%
2s时物质A的转化率为30%
D. 2s时物质B的浓度为0.7 mol•L-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上学期月考二化学卷(解析版) 题型:填空题
(12分)
Ⅰ.某温度下,0.1 mol/L的氢硫酸溶液中存在平衡:
①H2S(aq) H+(aq)+HS-(aq);②HS-(aq)
H+(aq)+HS-(aq);②HS-(aq) H+(aq)+S2-(aq);
H+(aq)+S2-(aq);
(1)氢硫酸溶液中存在的离子有 。(不完整不给分)
(2)若向H2S溶液中( )
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH增大
C.滴加新制氯水,平衡向左移动,溶液pH减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
Ⅱ.25℃时,部分物质的电离平衡常数如表所示:
化学式 | C | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH的电离平衡常数表达式 。
(2)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为 。
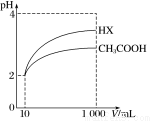
(3)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数 (填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是 。
Ⅲ.在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH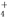 )=c(Cl-),则溶液显 性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
)=c(Cl-),则溶液显 性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上学期月考二化学卷(解析版) 题型:选择题
在密闭容器中发生如下反应:mA(g)+nB(s) pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.5倍,下列说法错误的是( )
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.5倍,下列说法错误的是( )
A.m+n<p B.平衡向左反应方向移动
C.B的转化率降低 D.A的体积分数增加
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)(已知:2SO2+O2 2SO3),反应过程中的能量关系可用右图简单表示(图中的ΔH 表示生成1 mol产物的数据)。 下列说法正确的是( )
2SO3),反应过程中的能量关系可用右图简单表示(图中的ΔH 表示生成1 mol产物的数据)。 下列说法正确的是( )

A.S8的燃烧热 ΔH=-a kJ·mol-1
B.1 mol SO2和过量 O2反应可释放出 b kJ 的热量
C.已知1个S8分子中有8个S-S,S=O的键能为d kJ·mol-1,O=O的键能为e kJ·mol-1,则S8分子中S-S的键能为(2d-a-e) kJ·mol-1
D.若使用V2O5作催化剂,当SO2(g)转化生成1mol SO3(g)时,释放的热量小于b kJ
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一上期中化学卷(解析版) 题型:实验题
分,共实验室用密度为1.25 g·mL-1,质量分数为36.5%的浓盐酸配制240 mL 0.1 mol·L-1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为 。
(2)配制240 mL 0.1 mol·L-1的盐酸应量取浓盐酸体积 mL,应选用容量瓶的规格______mL。
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) 。
A.用30 mL水洗涤烧杯内壁和玻璃棒2~3次,洗涤液均注入容量瓶,振荡 |
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀 |
C.将已冷却的盐酸沿玻璃棒注入容量瓶中 |
D.将容量瓶盖紧,振荡,摇匀 |
E.改用 加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线 处
(4)操作A中,将洗涤液都移入容量瓶,其目的是
(5)若实验过程中出现如下情况如何处理?
①加蒸馏水时不慎超过了刻度线
②向容量瓶中转移溶液时不慎有溶液溅出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com