
| A. | 甲苯的硝化、油脂的皂化均可看作取代反应 | |
| B. | 蛋白质水解生成葡萄糖放出热量,提供生命活动的能量 | |
| C. | 石油裂解的目的是为了提高轻质液体燃料的产量和质量 | |
| D. | 棉花和合成纤维的主要成分是纤维素 |
分析 A.苯的硝化反应中苯中的H被硝基取代,油脂在碱性条件下水解反应为皂化反应;
B.蛋白质水解生成氨基酸;
C.石油裂化的目的是为了提高轻质液体燃料(汽油,煤油,柴油等)的产量,特别是提高汽油的产量;
D.合成纤维是化学有机高分子材料.
解答 解:A.苯的硝化反应中苯中的H被硝基取代,油脂在碱性条件下水解反应为皂化反应,均属于取代反应,故A正确;
B.蛋白质水解生成氨基酸,不生成葡萄糖,故B错误;
C.石油裂化的目的是为了提高轻质液体燃料(汽油,煤油,柴油等)的产量,特别是提高汽油的产量,裂解的目的是为了获得乙烯、丙烯、丁二烯、丁烯、乙炔等,故C错误;
D.合成纤维是化学有机高分子材料,不是纤维素,故D错误.
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重常见有机物性质、组成、反应类型的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
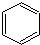
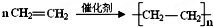 .
.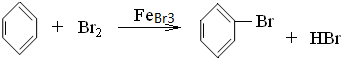 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
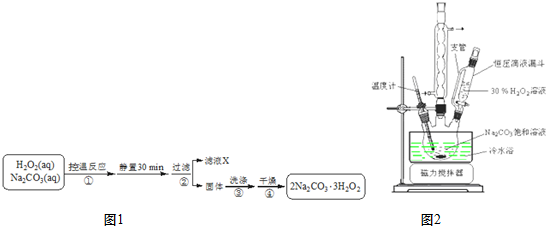
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑧ | B. | ④⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
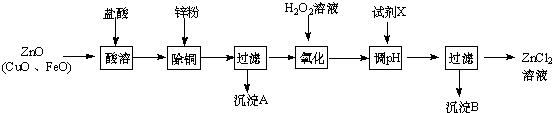
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.2 | 6.4 |
| Fe2+ | 5.8 | 8.8 |
 ,聚乳酸的结构简式为
,聚乳酸的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com