
| A、Li | B、Be | C、Mg | D、P |
科目:高中化学 来源: 题型:
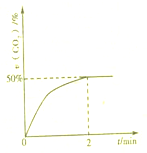 处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g).发生反应为:2CO(g)+SO2(g)?S(g)+2CO2(g)
处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g).发生反应为:2CO(g)+SO2(g)?S(g)+2CO2(g)| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4种 | B、5种 | C、6种 | D、7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KClO3是氧化剂 |
| B、1mol KClO3参加反应时有10mol电子转移 |
| C、该反应中的H2SO4只体现酸,不体现氧化性 |
| D、发生氧化反应与还原反应的氯元素的质量比为5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:6 | B、1:5 |
| C、5:1 | D、6:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原废液中含有的金属阳离子只有Fe2+和Cu2+ |
| B、该工厂原来使用的FeCl3溶液的物质的量浓度约为2 mol/L |
| C、若向500 mL废液中加入足量的稀HNO3溶液,在标况下产生NO气体4.48 L,则原废液中Fe2+和Cu2+的物质的量浓度之比为2:1 |
| D、可以使用硫氰化钾溶液检验该废液中是否含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O |
| B、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O |
| C、Na2CO3+H2SO4=Na2SO4+CO2↑+H2O |
| D、Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体区别于其他分散系的本质特征是丁达尔现象 |
| B、利用渗析法可以提纯氢氧化铁胶体 |
| C、非金属氧化物一定是酸性氧化物;碱性氧化物一定是金属氧化物 |
| D、金属阳离子被还原一定得到金属单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com