
【题目】设NA为阿伏加德罗常数,下列说法正确的是( )
A.由2H和18O所组成的水11 g,其中所含的中子数为4NA
B.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
C.0.1 mol H3O+中含有的电子数为NA
D.标准状况下,1L乙醇完全燃烧产生CO2分子的数目为![]()
科目:高中化学 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
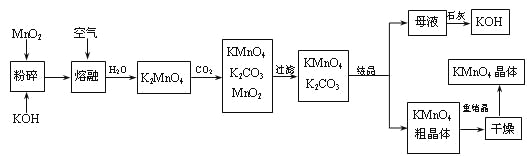
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列___(填序号)物质相似。
A.75%酒精 B.双氧水 C.苯酚 D.84消毒液(NaClO溶液)
(2)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:
___________________________________________________________________。
(3)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是:_______。
(4)上述流程中可以循环使用的物质有石灰、二氧化碳、___和___(写化学式)。
(5)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得_____mol KMnO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。

(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下列有机化合物,完成填空。
① C2H4 ② C2H2 ③ ![]() ④
④![]()
⑤ ![]() ⑥
⑥![]() ⑦
⑦![]() ⑧
⑧  ⑨反-2-丁烯
⑨反-2-丁烯
(1)①~⑨中,属于苯的同系物的是____(填序号,下同);
(2)②的电子式为___________;
(3)④的系统命名为 ___________;
(4)⑨的结构简式为 __________;
(5)③被酸性KMnO4溶液氧化的有机产物的结构简式为_____和__________;
(6)⑧在核磁共振氢谱中有_______组峰;
(7)①、 ③、 ⑨的沸点由高到低的顺序是____________;
(8)写出⑤的含有苯环且与⑤不同类别的一种同分异构体的结构简式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、铝、铁是三种重要的金属。请回答:
(1)三种金属与同浓度盐酸反应,反应最慢的是___(填选项)。
a.钠 b.铝 c.铁
(2)金属钠与水发生反应的离子方程式为___;(填选项)
a.2Na +2H2O=2NaOH+H2↑
b.2Na+2H2O=2Na++2OH-+H2↑
c.2Na +2H2O=2Na++2OH-+O2↑
(3)可观察到的实验现象正确的是__(填选项)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(4)填写a、b、c化学式并书写①的化学方程式(a、b、c均为含Al化合物);
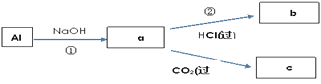
a:___,b:___,c:___;
①____________;
(5)Fe跟Cl2在一定条件下反应,所得产物为___。
(6)将该产物溶于水配成溶液,分装在两支试管中。请回答:
a.若向其中一支试管中滴加KSCN溶液,则溶液变成__色。
b.向另一支试管中滴加NaOH溶液,产生__色沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是

A. 正极反应为AgCl +e-=Ag +Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为常见气体制备、干燥、性质验证和尾气处理的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题,仪器装置可任意选用,必要时可重复选择。
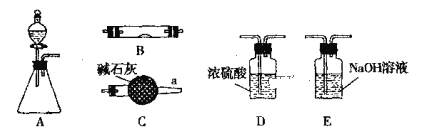
(1)若锥形瓶中盛装锌片,分液漏斗中盛装稀硫酸,可验证H2的还原性并检验其氧化产物。
①当仪器连接顺序为A→D→B→B→C时,两次使用B装置,其中所盛的药品依次是CuO、____________。
②检查好装置的气密性后加热B前必须进行的操作是_________________ 。
(2)若锥形瓶中盛装Na2O2固体,分液漏斗中盛装浓氨水,B中盛装固体催化剂,可进行氨的催化氧化,其反应产物为NO和H2O。
①各仪器装置按气流方向从左到右连接顺序A→C→B→C,请写出B中氨的催化氧化反应方程式____________________________ 。
②装置B中可能观察到的现象是_____________________________。
(3)若锥形瓶中盛装Na2SO3固体,分液漏斗中盛装H2SO4溶液,B中盛装Na2O2固体,可探究SO2气体与过氧化钠反应时是否有O2生成。根据气流方向,装置的连接顺序为:A→D→B→E,根据实验现象回答问题:
①若将带余烬的木条靠近E的导管口,木条复燃,SO2表现酸性氧化物的性质,则反应的方程式可能为:____________________;
②若在E的导管口未收集到任何气体,SO2只表现还原性,则反应的方程式可能为:____________________。
③装置B中观察到的现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯异氰尿酸是一种极强的氧化剂和氯化剂,利用氰尿酸(图1)与次氯酸在一定pH下反应可制备三氯异氰尿酸(图2),若原料完全反应生成三氯异氰尿酸,下列说法正确的是
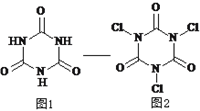
A. 氰尿酸的分子式为C6N3O3H3
B. HClO的电子式为 ![]()
C. 该转化过程有机物发生还原反应
D. 氰尿酸和次氯酸反应的物质的量之比为2 : 3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是
A. 某溶液![]() 有白色沉淀,说明原溶液中有Cl-
有白色沉淀,说明原溶液中有Cl-
B. 某溶液![]() 有白色沉淀,说明原溶液中有SO42-
有白色沉淀,说明原溶液中有SO42-
C. 某溶液![]() 有蓝色沉淀,说明原溶液中有Cu2+
有蓝色沉淀,说明原溶液中有Cu2+
D. 某溶液![]() 生成无色气体,说明原溶液中有CO32-
生成无色气体,说明原溶液中有CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com