
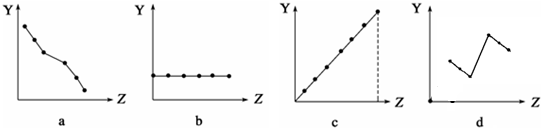
分析 (1)ⅡA族元素的价电子数为2,随核电荷数增大,价电子数不变;
(2)第三周期元素的最高化合价,随核电荷数增大,最高化合价由+1价递增到+7,最后以稀有气体0价结束;
(3)电子层结构相同,核电荷数越大,离子半径越小,最外层电子数相同,电子层越多,离子半径越大;
(4)同周期随原子序数增大,原子半径减小;
(5)碱金属随核电荷数增大,金属性增强,阳离子氧化性减弱.
解答 解:(1)ⅡA族元素的价电子数为2,随核电荷数增大,价电子数不变,故图b符合,故选:b;
(2)第三周期元素的最高化合价,随核电荷数增大,最高化合价由+1价递增到+7,最后以稀有气体0价结束,故图c符合,故选:c;
(3)电子层结构相同,核电荷数越大,离子半径越小,所以离子半径Na+>Mg2+>Al3+、P3->S2->Cl-,最外层电子数相同,电子层越多,离子半径越大,所以离子半径Cl->Na+.所以离子半径P3->S2->Cl->Na+>Mg2+>Al3+,故图d符合,故选:d;
(4)同周期主族元素,随原子序数递增原子半径减小,故图a符合,故选:a;
(5)碱金属随核电荷数增大,金属性增强,阳离子氧化性减弱,故图a符合,故选:a.
点评 本题以图象形式考查元素周期律,难度不大,注意规律的归纳与总结与理解,有利于基础知识的巩固.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①③④ | C. | ①②③ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
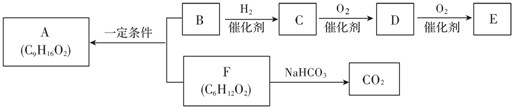
 A,B,C,D,E,F是原子序数依次增大的前四周期的常见元素,其相关信息如下表:
A,B,C,D,E,F是原子序数依次增大的前四周期的常见元素,其相关信息如下表:| A | 宇宙中含量最丰富的元素 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | 最高价氧化物对应的水化物与其氢化物反应生成盐 |
| D | 原子核外电子有8种不同的运动状态 |
| E | 基态原子核外有六个未成对电子 |
| F | 原子最外层只有一个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3p2表示3p能级有两个轨道 | |
| B. | 处于最低能量的原子叫做基态原子 | |
| C. | 同一原子中,1s、2s、3s电子的能量逐渐减小 | |
| D. | 同一原子中,1p、2p、3p电级的轨道数依次增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液与等浓度NaOH溶液等体积混合后,pH>7 | |
| B. | 测得Na2CO3的碱性比CH3COONa溶液强,因此得出醋酸的酸性比碳酸强的结论 | |
| C. | 若向该溶液中加入少量CH3COONa固体,恢复至常温后,c(CH3COOH)比原来增大 | |
| D. | 若向一定浓度的CH3COONa溶液中加入少量CH3COONa固体,恢复至常温后,其水解程度比原来下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
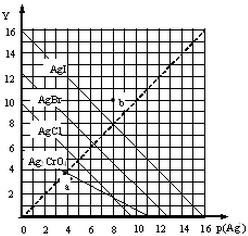 卤化银AgX及Ag2CrO4的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)═-lgc(Ag+),纵坐标Y=-lgc(X-)或lgc(CrO42-).下列说法正确的是( )
卤化银AgX及Ag2CrO4的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)═-lgc(Ag+),纵坐标Y=-lgc(X-)或lgc(CrO42-).下列说法正确的是( )| A. | 该温度下Ag2CrO4的Ksp约为1×10-22 | |
| B. | a点可表示AgCl的饱和溶液 | |
| C. | b点c(Ag+)=c(I-) | |
| D. | 该温度下AgCl、AgBr饱和溶液中:c(Cl-)<c(Br-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 的合成方法有:
的合成方法有: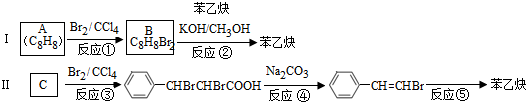
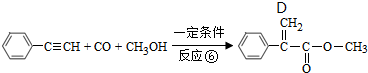
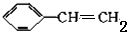 ,反应①,②涉及的反应类型是加成反应、消去反应.
,反应①,②涉及的反应类型是加成反应、消去反应.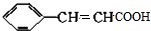 ,反应⑤的化学方程式为
,反应⑤的化学方程式为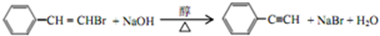 (注明反应条件)
(注明反应条件)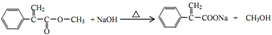 .
.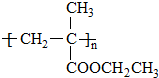 单体的结构简式为CH2=C(CH3)COOCH2CH3.用类似反应⑥的方法,利用合适的原料可以合成该单体,化学方程式为
单体的结构简式为CH2=C(CH3)COOCH2CH3.用类似反应⑥的方法,利用合适的原料可以合成该单体,化学方程式为 .
.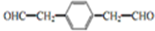 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
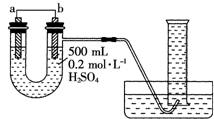 现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题:
现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量.量筒的规格为1000mL,供选择的电极材料有纯铜片和纯锌片.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com