
 .
. 分析 (1)同温同压下,气体密度之比等于其相对分子质量之比,由气体体积相等可推出:$\frac{{{M_{r_1}}}}{{{M_{r_2}}}}=\frac{m_1}{m_2}$;
(2)生成白色沉淀为碳酸钙,根据碳原子守恒计算二氧化碳的物质的量,碱石灰增重为二氧化碳与水的质量,计算生成水的物质的量,根据原子守恒确定分子中C、H原子数目,结合相对分子质量计算确定O原子数目,进而确定弱酸的分子式;
(3)乳酸分子能发生自身酯化反应,含有-COOH、-OH,其催化氧化物不能发生银镜反应,说明-OH连接的C原子是只含有一个H原子,结合分子式确定弱酸的结构简式;
(4)乳酸发生酯化反应生成环酯.
解答 解:(1)同温同压下,气体密度之比等于其相对分子质量之比,由气体体积相等可推出:$\frac{{{M_{r_1}}}}{{{M_{r_2}}}}=\frac{m_1}{m_2}$,故弱酸的相对分子质量为2×$\frac{0.9}{0.02}$=90,故答案为:90;
(2)0.9g弱酸的物质的量为0.01 mol,完全燃烧生成CO2 为$\frac{3g}{100g/mol}$=0.03 mol,生成H2O为$\frac{{1.86g-0.03mol×44g•mo{l^{-1}}}}{{18g•mo{l^{-1}}}}$=0.03mol,所以一个乳酸分子中有3个碳原子和6个H原子,又因其相对分子质量为90,故含氧原子数为$\frac{90-3×12-6}{16}$=3,所以乳酸的分子式为C3H6O3,
故答案为:C3H6O3;
(3)乳酸分子能发生自身酯化反应,含有-COOH、-OH,其催化氧化物不能发生银镜反应,说明-OH连接的C原子是只含有一个H原子,乳酸的结构简式为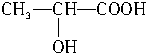 ,故葡萄糖发酵生成乳酸的化学方程式为:CH2OH(CHOH)4CHO→2CH3CH(OH)COOH,
,故葡萄糖发酵生成乳酸的化学方程式为:CH2OH(CHOH)4CHO→2CH3CH(OH)COOH,
故答案为:CH2OH(CHOH)4CHO→2CH3CH(OH)COOH;
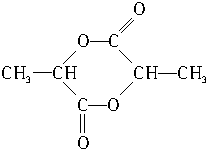
(4)乳酸在催化剂作用下发生反应,生成分子式为C6H8O4的环状酯的结构简式: ,
,
故答案为: .
.
点评 本题考查有机物分子式与结构的确定,掌握燃烧法利用原子守恒确定有机物分子式方法,掌握官能团的性质与转化.


科目:高中化学 来源: 题型:选择题
| A. | 某无色透明的溶液中:Ca2+、NH4+、CO32-、HCOO- | |
| B. | 溶解有AlCl3的溶液中:Na+、K+、SO42-、S2- | |
| C. | 25℃时,水电离出的c(H+)=1×l0-l3mol/L的溶液中:K+、Ba2+、NO3-、I- | |
| D. | 离子浓度均为0.1mol/L的溶液中:Na+、Fe3+、CH3COO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
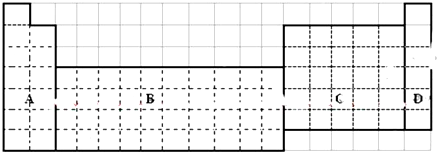
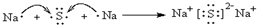 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
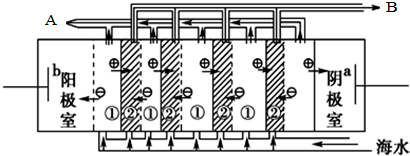 ,电渗阴极室可获得的重要化工原料有氢气、氢氧化钠.
,电渗阴极室可获得的重要化工原料有氢气、氢氧化钠.| CaSO4 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
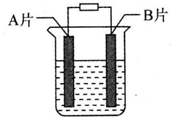 【实验目的】利用所学知识,设计原电池装置.
【实验目的】利用所学知识,设计原电池装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
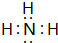 ,请用电子式表示A与C形成化合物的过程
,请用电子式表示A与C形成化合物的过程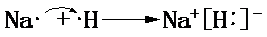 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
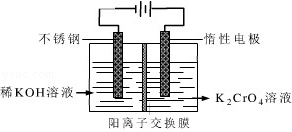 铬是人体必需的微量元素,它与脂类代谢有密切联系,但铬过量会引起污染,危害人类健康.
铬是人体必需的微量元素,它与脂类代谢有密切联系,但铬过量会引起污染,危害人类健康.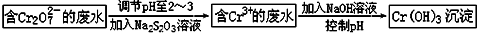
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com