
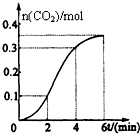
 CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )| A. | 反应2~4分钟内平均反应速率最大 | |
| B. | 反应4分钟后平均反应速率最小 | |
| C. | 反应开始4分钟内温度对反应速率的影响比浓度大 | |
| D. | 反应在第2分钟初至第3分钟末生成CO2的平均反应速率为0.1mol/(L•min) |
分析 CaCO3与稀盐酸的反应为放热反应,随着反应的进行,温度逐渐升高,盐酸浓度逐渐降低,结合各时间段二氧化碳物质的量的变化可比较反应速率的大小,
A、相同时间内,生成的二氧化碳的体积越大,表明反应速率越快,据此结合图象判断;
B、4min后氢离子浓度起主要作用,氢离子浓度降低;
C、随反应进行氢离子浓度降低,氢离子浓度变化使反应速率降低,由图象可知,2~4min反应速率最快,说明反应为放热反应,0~4分钟温度对反应速率起主要作用,4min后反应速率又降低,氢离子浓度起主要作用;
D、反应速率V=$\frac{△c}{△t}$计算判断.
解答 解:A.由图象可知,0~2分钟时间内,生成二氧化碳0.1mol,2~4分钟时间内,生成二氧化碳0.2mol,4~6分钟时间内,生成二氧化碳0.1mol,则反应刚开始时反应速率较小,然后逐渐增大,最后减小,故A正确;
B.由图象可知,反应4分钟后曲线斜率变小,则反应速率减小,故B正确;
C.随反应进行氢离子浓度降低,氢离子浓度变化使反应速率降低,由图象可知,0~2分钟反应刚开始,温度较低此时反应速率由氢离子浓度决定,2~4min反应速率最快,2~4分钟温度对反应速率起主要作用,4min后反应速率又降低,氢离子浓度起主要作用,故C正确;
D、图象分析可知,反应在第2分钟初至第4分钟末生成CO2的平均反应速率=$\frac{0.3mol/L-0.1mol/L}{4min-2min}$=0.1 mol/(L•min),所以反应在第2分钟初至第3分钟末生成CO2的平均反应速率不是0.1 mol/(L•min),故D错误;
故选D.
点评 本题考查反应速率的定量表示及有关图象,为高频考点,侧重于学生的分析能力的考查,难度中等,注意根据速率定义式进行理解,注意理解影响反应速率的因素.


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可能为甲烷和乙烷的混合物 | B. | 一定有乙烯 | ||
| C. | 混合物中可能含有丙烷 | D. | 两种气态烃一定都有四个H原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2015年科学家首次利用X射线观测到化学反应过渡态的形成.在固体催化剂表面“抓取”CO分子和O原子,并“配对”生成CO2分子. 下列关于说法正确的是( )
2015年科学家首次利用X射线观测到化学反应过渡态的形成.在固体催化剂表面“抓取”CO分子和O原子,并“配对”生成CO2分子. 下列关于说法正确的是( )| A. | CO与CO2均为酸性氧化物 | |
| B. | 大量CO2的排放可导致酸雨的形成 | |
| C. | CO与O形成化学键过程中有电子转移 | |
| D. | 相同条件下,CO的密度比CO2的密度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
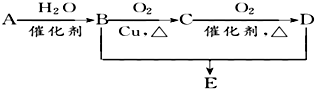 有机物A的结构简式为CH2=CH2,可发生以下系列转化,已知B、D是生活中常见的两种有机物,D的水溶液呈酸性,B与D的反应为酯化反应.下列说法不正确的是( )
有机物A的结构简式为CH2=CH2,可发生以下系列转化,已知B、D是生活中常见的两种有机物,D的水溶液呈酸性,B与D的反应为酯化反应.下列说法不正确的是( )| A. | 由B、D制备E常用浓H2SO4作脱水剂 | |
| B. | D、E都能与NaOH溶液反应 | |
| C. | E、D、B三种物质可以用饱和Na2CO3溶液鉴别 | |
| D. | 75%的B溶液常用于医疗消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加KI溶液时,转移2 mol e-时生成 1 mol白色沉淀 | |
| B. | 通入SO2后溶液逐渐变成无色,不是 SO2的漂白性 | |
| C. | 通入SO2时,SO2与I2反应,I2作氧化剂 | |
| D. | 上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA | |
| B. | 1molNa2CO3晶体中含CO32-离子数小于NA | |
| C. | 惰性电极电解食盐水,若线路中通过NA电子电量,则阳极产生气体11.2L | |
| D. | 0.1molCaO2(过氧化钙)中含阴离子数是0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
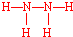 ,过氧化氢的电子式
,过氧化氢的电子式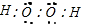 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com