
����Ŀ����Ԫ�ؿ����γ������������������������й㷺��Ӧ�á�
��1����NF3���ӻ�Ϊ�ȵ�����ķ���Ϊ��
��2�����Ͱ�����640��ɷ����û���Ӧ������֮һ�ľ����ṹ��ͼ�ס�
��д��Fe3+�Ļ�̬�����Ų�ʽ��
��д���÷�Ӧ�Ļ�ѧ����ʽ����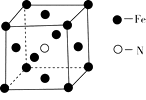
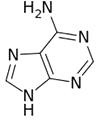
�� �� ��
��3��ά����B4�ṹ��ͼ�ң���1 molά����B4�����к��ЦҼ�����ĿΪmol��
��4���������Ľṹ��ͼ�����к���������ţ���
a�����Թ��ۼ� b���Ǽ��Թ��ۼ� c����λ�� d�����
����̼ԭ�ӵ��ӻ���ʽ����
���𰸡�
��1��NCl3��ClO2��
��2��[Ar]3d5��8Fe��2NH3 ![]() 2Fe4N��3H2
2Fe4N��3H2
��3��16
��4��a b c d��sp2 ��sp3
���������⣺��1���ȵ�������ԭ�����͵�������ͬ���ʲ���ͬ���������ͬ���ڱ任��˼·��д����Ӧ�ĵȵ�����NCl3��ClO2�ȣ���2������ͼ����Fe:8��1/8+6��1/2=4:����ʽΪ8Fe��2NH3 ![]() 2Fe4N��3H2 ;(3)���Ϲ���10�����������3���������2��̼�����1��̼����������16mol����4�������м�̼Ϊsp3 �� �뵪ԭ���γ�̼��˫����̼Ϊsp2��
2Fe4N��3H2 ;(3)���Ϲ���10�����������3���������2��̼�����1��̼����������16mol����4�������м�̼Ϊsp3 �� �뵪ԭ���γ�̼��˫����̼Ϊsp2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������
��1������VSEPRģ���жϣ�������������ԭ�Ӷ���ͬһƽ���ϵ�һ���� ��
A.SO32����NO2��
B.NO3����SO3
C.H3O+��ClO3��
D.PO43����SO32��
��2��CaF2�ľ�����ͼ��ʾ�� 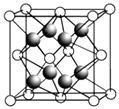
�������й�CaF2�ı�����ȷ����
a��Ca2+��F��������ھ�����������
b��F�������Ӱ뾶С��Cl�� �� ��CaF2���۵����CaCl2
c�����������ӱ�Ϊ2��1�����ӻ��������CaF2���幹����ͬ
d��CaF2�еĻ�ѧ��Ϊ���Ӽ������CaF2������״̬���ܵ���
��CaF2������ˮ���������ں�Al3+����Һ�У�ԭ�����������ӷ���ʽ��ʾ����֪[AlF6]3������Һ�п��ȶ����ڣ���
�۾�����F������λ���� �� ��һ��Ca2+�Ⱦ����������Ca2+������
��3��ͭ��п����Ԫ�صĵ�һ�����ܡ��ڶ������������ʾ
������/kJmol��1 | I1 | I2 |
ͭ | 746 | 1958 |
п | 906 | 1733 |
��д��Cuԭ�Ӻ�������Ų�ʽ��
��ͭ�ĵ�һ�����ܣ�I1��С��п�ĵ�һ�����ܣ���ͭ�ĵڶ������ܣ�I2��ȴ����п�ĵڶ������ܣ�����Ҫԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������14C������˵���в���ȷ���ǣ� ��
A. 14Cԭ����C60����̼ͨԭ�ӵĻ�ѧ������ͬ
B. 14Cԭ����14Nԭ��������������ͬ
C. ��C60��ͬ��������
D. ��12C��13C��̼Ԫ�ص�����ͬλ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��3��5����������������Ҫ���л��ϳ��м��壬��������Ȼ���ʰ������صĺϳɡ�һ���Լ䱽����Ϊԭ�ϵĺϳɷ�Ӧ���£�
�״������Ѻ�3,5�������������ӵIJ����������ʼ��±���
���� | �е�/�� | �۵�/�� | �ܶ�(20��) /g��cm��3 | �ܽ��� |
�״� | 64. 7 |
| 0. 7915 | ������ˮ |
���� | 34. 5 |
| 0. 7138 | ����ˮ |
3,5�������������� |
| 33��36 |
| �����ڼ״������ѣ�����ˮ |
��1����Ӧ�������ȷ�����״����ټ������ѽ�����ȡ��
�ٷ�����״��IJ�������
����ȡʱʹ�õ���Ҫ����Ϊ��������������е��л���IJ�������
��2������õ����л��������ñ���NaHCO3��Һ������ʳ��ˮ����������ˮ����ϴ�ӡ��ñ���NaHCO3 ��Һϴ�ӵ�Ŀ������
��3��ϴ����ɺ�ͨ�����²������롢�ᴿ�����ȷ�IJ���˳����(����ĸ)��
a�������ȥ���� b���ؽᾧ c�����˳�ȥ����� d��������ˮCaCl2����
��4����Һ���볣���ü�ѹ���ˡ���ѹ������ɺ�Ӧ�Ȳ�ȥ���ӳ����ú�����ƿ����Ƥ���ٹرճ����ã���Ŀ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼΪʵ������ȡ���ռ��������������������������������ʵ���װ��ͼ�� 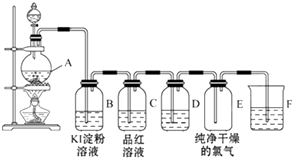
��1����Ӧǰ����װ��A��װŨ���ᣨ��д�������ƣ�װMnO2����д�������ƣ�װ��A�з�Ӧ�Ļ�ѧ����ʽΪ ��
��2��װ��B�е���������Ӧ�Ļ�ѧ����ʽΪ ��
��3��װ��D����װ�Լ��� �� ������
��4��װ��F�з�����Ӧ�Ļ�ѧ����ʽΪ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����1��Zn��s��+ ![]() O2��g���TZnO��s����H=��348.3kJmol��1 �� ��2��2Ag��s��+
O2��g���TZnO��s����H=��348.3kJmol��1 �� ��2��2Ag��s��+ ![]() O2��g���TAg2O��s����H=��31.0kJmol��1 �� ��Zn��s��+Ag2O��s���TZnO��s��+2Ag��s���ġ�H���ڣ� ��
O2��g���TAg2O��s����H=��31.0kJmol��1 �� ��Zn��s��+Ag2O��s���TZnO��s��+2Ag��s���ġ�H���ڣ� ��
A.��379.3kJmol��1
B.��317.3kJmol��1
C.��332.8kJmol��1
D.317.3kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�� ![]()
ˮ������EΪ�������ռ������������Ʒ�ɹ˪��E��һ�ֺϳ�·�����£�
��ش��������⣺
��1��һԪ��A��������������ԼΪ21.6%����A�ķ���ʽΪ �� �ṹ������ʾAֻ��һ������A������Ϊ ��
��2��B��������Һ������Ӧ�Ļ�ѧ����ʽΪ ��
��3����һ��ȡ��������C�����������ţ���ʹ�õ��Ⱥ�˳��д�������Լ� ��
��4��A��D���Ƿ��л�Ϊͬϵ���ϵ�����ʣ���С����ޡ��� �� ����D��E���Լ��� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com