
| A. | 用NaOH溶液吸收Cl2:Cl2+2OH-=2Cl-+H2O | |
| B. | Fe2(SO4)3和Ba(OH)2溶液混合:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 向AgCl悬浊液中加入Na2S溶液:2AgCl+S2-=Ag2S+2Cl- | |
| D. | 向NaHCO3-溶液中加入澄清石灰水:HCO+OH-=CO32-+H2O |
分析 A.二者反应生成氯化钠和次氯酸钠、水;
B.漏掉钡离子与硫酸根离子反应生成硫酸钡沉淀;
C.氯化银与硫化钠反应生成硫化银和氯化钠;
D.部分反应客观事实.
解答 解:A.用NaOH溶液吸收Cl2,离子方程式:Cl2+2OH-=ClO-+Cl-+H2O,故A错误;
B.Fe2(SO4)3和Ba(OH)2溶液混合,离子方程式:3Ba2++3SO42-+2Fe3++6OH-=2Fe(OH)3↓+3BaSO4↓,故B错误;
C.向AgCl悬浊液中加入Na2S溶液,离子方程式:2AgCl+S2-=Ag2S+2Cl-,故C正确;
D.向NaHCO3溶液中加入足量澄清石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,侧重考查复分解反应离子方程式书写,明确反应实质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 混合液 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 正极附近C(H+)逐渐增大 | |
| B. | 正极上产生气泡 | |
| C. | 正极、负极附近C(H+)基本不变 | |
| D. | Zn片、Cu片同时冒出气泡,则说明Zn片不纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中含有羟基的物质溶于水后,溶液一定显酸性 | |
| B. | 丙酸、乙酸甲酯、甲酸乙酯互为同分异构体 | |
| C. | 能发生银镜反应的一定是醛 | |
| D. | 乙醇发生酯化反应断裂碳氧键而失去羟基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①③④ | B. | ①④ | C. | ②③⑤ | D. | 除② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
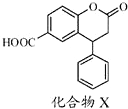
| A. | 分子式为C16H14O4 | |
| B. | 1mol化合物X在一定条件下最多加成6molH2 | |
| C. | 分子中有三种官能团,酸性条件下水解后官能团还是三种 | |
| D. | 1mol化合物X最多能与2molNaOH反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com