
【题目】在容积为2L的恒容密闭容器中发生反应xA(g)+ yB(g)![]() zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系;则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系;则下列结论正确的是
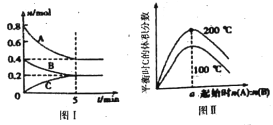
A. 图II所知反应xA(g)+yB(g) ![]() zC(g) △H<0,且a=2
zC(g) △H<0,且a=2
B. 200℃时,该反应的平衡常数为25
C. 200℃时,反应从开始到平衡的平均速率v(B)=0.04mol/(Lmin)
D. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
【答案】B
【解析】A项,由图II可知:升高温度,平衡时C的体积分数增大,说明升高温度化学平衡向正反应方向移动,又因为升高温度,化学平衡向吸热方向移动,所以正反应为吸热反应,△H>0;根据图Ⅰ数据可知该反应的化学方程式为2A+B![]() C,只有当两种反应物按方程式的计量数之比加入时,达到平衡时生成物C的体积分数才最高,所以a=2,综上分析,A错误。B项,由图Ⅰ可得,200℃,平衡时c(A)=0.4mol÷2L=0.2mol/L,c(B)=c(C)=0.2mol÷2L=0.1mol/L,由前面的分析化学方程式为2A+B
C,只有当两种反应物按方程式的计量数之比加入时,达到平衡时生成物C的体积分数才最高,所以a=2,综上分析,A错误。B项,由图Ⅰ可得,200℃,平衡时c(A)=0.4mol÷2L=0.2mol/L,c(B)=c(C)=0.2mol÷2L=0.1mol/L,由前面的分析化学方程式为2A+B![]() C,所以200℃时,该反应的平衡常数为:K=
C,所以200℃时,该反应的平衡常数为:K=![]() =25,故B正确。C项,200℃时,反应从开始到平衡的平均速率v(B)=(0.4-0.2)mol÷2L÷5min=0.02mol/(Lmin),故C错误。D项,当外界条件由200℃降温到100℃,平衡常数K一定变化,原平衡一定被破坏,正逆反应速率均减小,故D错误。
=25,故B正确。C项,200℃时,反应从开始到平衡的平均速率v(B)=(0.4-0.2)mol÷2L÷5min=0.02mol/(Lmin),故C错误。D项,当外界条件由200℃降温到100℃,平衡常数K一定变化,原平衡一定被破坏,正逆反应速率均减小,故D错误。


科目:高中化学 来源: 题型:
【题目】丙酮是一种常用的有机溶剂,可与水以任意体积比互溶,密度小于1g/mL,沸点约55℃,分离水和丙酮时最合理的方法是( )
A.蒸发
B.分液
C.过滤
D.蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)肼(N2H4)是火箭推进器中常用的高能燃料,已知0.4mol液态肼和足量H2O2反应,生成N2和水蒸气,放出256.65kJ的热量,请写出该反应的热化学方程式:__________________________。
(2)工业上制氢气的一个重要反应是:CO(g)+H2O(g)=CO2(g)+H2(g)
已知在25℃时:C(石墨)+ ![]() O2(g)=CO(g)△H1=-111kJ·mol-1
O2(g)=CO(g)△H1=-111kJ·mol-1
H2(g)+ ![]() O2(g)=H2O(g)△H2=-242kJ·mol-1
O2(g)=H2O(g)△H2=-242kJ·mol-1
C(石墨)+O2(g)=CO2(g)△H3=-394kJ·mol-1
试计算25℃时一氧化碳与水作用转化为氢气和二氧化碳反应的反应热△H=________kJ·mol-1
(3)高铁酸钾(K2FeO4)可作净水剂,也可用于制造高铁电池。高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O=3Zn(OH)2+Fe(OH)3+4KOH,该电池放电时正极反应式为____________。
(4)用该电池电解100mL1mol·L-1的AgNO3溶液,写出电解反应方程式:____________________。当电路中通过0.01mol电子时,被电解溶液的pH为________(溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | K=1.77×10-4 | K=5.0×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
下列叙述错误的是
A. NaCN溶液中通人少量CO2发生的离子反应为:CN-+H2O+CO2=HCN+HCO3-
B. 等体积、等物质的量浓度的HCOONa和NaCN溶液中所含阴离子总数前者大于后者
C. 等物质的量浓度的NaHCO3和Na2CO3混合溶液中:c(Na+)>c(OH-)>c(HCO3-)>c(CO32-)>c(H+)
D. 中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 开启啤酒瓶后,瓶中马上泛起大量泡沫
B. 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C. 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
D. 对于2HI(g)![]() H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氨酯类高分子材料PU用途广泛,其合成反应为:
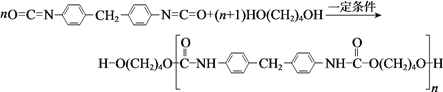
下列说法不正确的是
A. HO(CH2)4OH的沸点高于CH3CH2CH2CH3
B. 高分子材料PU在强酸、强碱中能稳定存在
C. 合成PU的两种单体的核磁共振氢谱中均有3个吸收峰
D. 以1,3-丁二烯为原料,可合成HO(CH2)4OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配平该方程式__KMnO4+__HCl (浓) =__KCl+__MnCl2+__Cl2↑+__H2O
(2)反应中(1)中____是还原剂,_____是还原产物 .
(3)该反应的离子方程式为:_______________________
(4)用双线桥法分析此氧化还原反应____________________________
(5)NA表示阿伏伽德罗常数,若产生标准状况下的气体的体积为2.24L ,则反应过程中转移电子的数目为_________,被氧化的HCl的质量为_____g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,回答下列问题:
(1)现有下列物质;①熔融的NaCl ②液态HCl ③蔗糖 ④汞 ⑤NaOH溶液 ⑥稀硫酸 ⑦CO2 ⑧KCl晶体
其中属于电解质的是__________;属于非电解质的是__________;能导电的有__________。
(2)按要求填空。
①NaHSO4溶液(写出电离方程式)____________________________。
②苏打和澄清石灰水反应(写出离子方程式)_______________________________
(3)配平下列氧化还原方程式:
①_____Fe+_____HNO3 = _____Fe(NO3)3+_____NO↑+_____H2O
②____CO+____ Fe2O3 ![]() ____Fe+_____CO2
____Fe+_____CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10 mL浓度均为3 mol·L-1的HNO3与H2SO4的混合溶液中加入1.92 g铜,充分反应后,设溶液体积仍为10 mL。求:
(1)产生的气体在标准状况下的体积是多少升_____?
(2)反应后溶液中各溶质的离子浓度是多少 ______? (反应完溶液中溶质的离子有Cu2+、H+、、NO3-、 SO42-)(以上要求写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com