
| ���� | Fe��OH��3 | Cu��OH��2 | Zn��OH��2 | CuS | ZnS |
| Ksp | 4.0��10-38 | 5.0��10-20 | 2.0��10-16 | 8.5��10-45 | 1.2��10-23 |
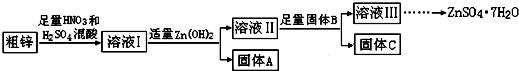
���� ���ú�ͭ�����Ĵ�п�Ʊ�����п����ͭ��ͭ���������ᡢ���ᷴӦ������ͭ���ӡ������ӣ�����Ksp��֪��������ͭ��������п�����ܣ�����Һ�м���Zn��OH��2���õ�����AΪFe��OH��3��������������B����B��ͬ����C�ɷֲ�ͬ������Һ��Ϊ����п��Һ���Ʊ���ˮ������п����ֹ�ᾧˮʧˮ������ȴ�ᾧ�����ˡ�ϴ�ӡ�������õ��ϴ���������п���壬
��1���������Ϸ�������ɷ�����֪Ҫ����ͭ���ӣ�
��2��Cu�����ᷴӦ��������ͭ��NO��ˮ��
��3�������ܶȻ�����������Һ�е�����������Ũ�ȣ��ټ���pH��
��4����B��Zn�������CΪZn��Cu�Ļ����ɹ�ϵʽZn��Cu��2e-��Zn2+��Cu2+��2OH-��Cu��OH��2��Zn��OH��2��֪���������������Ϊ���������ӵ�������
��5��Na2S����Һ��ˮ���Լ��ԣ�
��� �⣺���ú�ͭ�����Ĵ�п�Ʊ�����п����ͭ��ͭ���������ᡢ���ᷴӦ������ͭ���ӡ������ӣ�����Ksp��֪��������ͭ��������п�����ܣ�����Һ�м���Zn��OH��2���õ�����AΪFe��OH��3��������������B����B��ͬ����C�ɷֲ�ͬ������Һ��Ϊ����п��Һ���Ʊ���ˮ������п����ֹ�ᾧˮʧˮ������ȴ�ᾧ�����ˡ�ϴ�ӡ�������õ��ϴ���������п���壬
��1�������Ϸ�����֪����A����Ҫ�ɷ���Fe��OH��3������B��Ϊ������ͭ������ͭ����п��п�ȣ����ڳ�ȥ��Һ���е�Cu2+��
�ʴ�Ϊ��Fe��OH��3����ȥ��Һ���е�Cu2+��
��2����п�е�ͭ��ϡ������Һ��Ӧ�����ӷ���ʽΪ3Cu+8H++2NO3-=3Cu2++2NO��+4H2O���ʴ�Ϊ��3Cu+8H++2NO3-=3Cu2++2NO��+4H2O��
��3������Һ����c��Cu2+��Ϊ0.05mol•L-1����Ksp=5.0��10-20��֪��c��OH-��=$\sqrt{\frac{5��1{0}^{-20}}{0.05}}$mol/L=1.0��10-9mol/L����c��H+��=1.0��10-5mol/L��
����pH��5��
�ʴ�Ϊ��5��
��4����B��Zn�������CΪZn��Cu�Ļ���ȡ8.320gC��ȫ�ܽ���500mL1mol•L-1ϡ�����У����ռ���2240mL���壬��n��NO��=$\frac{2.24L}{22.4L/mol}$=0.1mol��ת��0.3mol���ӣ��ɹ�ϵʽZn��Cu��2e-��Zn2+��Cu2+��2OH-��Cu��OH��2��Zn��OH��2��֪��������Ϊ8.320g+0.3mol��17g/mol=13.42g��������B����һ�����ʣ�ȡ���ֹ���C���Թ��У��������������ᣬ�г�������ζ���������������Ϊ���⣬��ʵ��Ϊ�Ʊ�����п����BӦΪZnS������C�к���ZnS��CuS�������ᷴӦ�������������Ϊ��п����ӦΪ��ZnS+2H+=H2S��+Zn2+��
�ʴ�Ϊ��13.42��ZnS+2H+=H2S��+Zn2+��
��5��Na2S����Һ��ˮ���Լ��ԣ������Ƶõ�ZnS�лẬ�н϶��Zn��OH��2��
�ʴ�Ϊ��Zn��OH��2��
���� ���⿼�������ú�ͭ�����Ĵ�п�Ʊ�����п�����̷�����������ѧ���ķ�����ʵ��ͼ��������Ŀ��飬�漰���Ļ���������ܽ�ƽ��Ӧ�á�������ԭ��֪ʶ����������ܽ�ƽ����йؼ����ǽⱾ��ؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ������
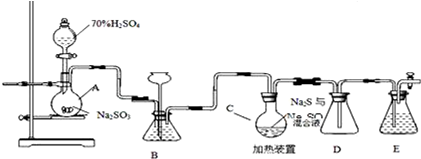
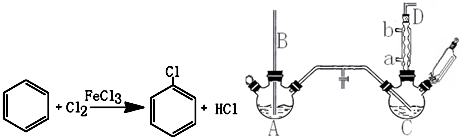
������ 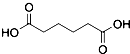 ��һ�ֹ�ҵ�Ͼ�����Ҫ������л���Ԫ�ᣬ�ڻ����������л��ϳɹ�ҵ��ҽҩ��������ȷ��涼����Ҫ���ã��ܹ��������η�Ӧ��������Ӧ�ȣ��������Ԫ�����۳ɸ߷��Ӿۺ���ȣ���������������ж�Ԫ�����еĵڶ�λ��ʵ���Һϳɼ�����ķ�Ӧԭ����ʵ��װ��ʾ��ͼ��
��һ�ֹ�ҵ�Ͼ�����Ҫ������л���Ԫ�ᣬ�ڻ����������л��ϳɹ�ҵ��ҽҩ��������ȷ��涼����Ҫ���ã��ܹ��������η�Ӧ��������Ӧ�ȣ��������Ԫ�����۳ɸ߷��Ӿۺ���ȣ���������������ж�Ԫ�����еĵڶ�λ��ʵ���Һϳɼ�����ķ�Ӧԭ����ʵ��װ��ʾ��ͼ�� +8HNO3��3
+8HNO3��3 +8NO��+7H2O
+8NO��+7H2O| ���� | �ܶȣ�20�棩 | �۵� | �е� | �ܽ��� | ��Է������� |
| ������ | 0.962g/cm3 | 25.9�� | 160.8�� | 20��ʱˮ���ܽ��3.6g���ɻ������Ҵ����� | 100 |
| ������ | 1.36g/cm3 | 152�� | 337.5�� | ��ˮ�е��ܽ�ȣ�15��ʱ1.44g��25��ʱ2.3g���������Ҵ��������ڱ��� | 146 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��Ŀ | ���ȱ� | β�� | ��ȷ������ | ��ʧ���� |
| ����ʧ����kg/t�� | 13 | 24.9 | 51.3 | 89.2 |
�鿴�𰸺ͽ���>>
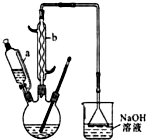
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
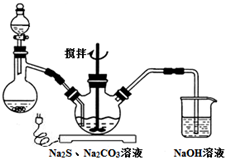 NaCNΪ�綾���ij��ȤС������ϵ�֪��ʵ�������NaCN��Һ��ʹ��Na2S2O3��Һ���нⶾ���٣����ǿ�չ����������ʵ�飬�����Ҫ��ش����⣺
NaCNΪ�綾���ij��ȤС������ϵ�֪��ʵ�������NaCN��Һ��ʹ��Na2S2O3��Һ���нⶾ���٣����ǿ�չ����������ʵ�飬�����Ҫ��ش����⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��ȩ��518��ʱ��;�����;����ֽ�Ϊ�����һ����̼����ͼ��ʾ����;���������仯����ʾ��ͼ�����������У�������ǣ�������
��ȩ��518��ʱ��;�����;����ֽ�Ϊ�����һ����̼����ͼ��ʾ����;���������仯����ʾ��ͼ�����������У�������ǣ�������| A�� | ��������������ʱ��;������;��������ȩ��ת������ͬ | |
| B�� | ;�����Ǽ������ʱ�����仯���ߣ��Ҵ�����I2 | |
| C�� | ;������;������ʱ䣨��H����ͬ | |
| D�� | �����������������Ӧ���ʣ������淴Ӧ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 8.5 | B�� | 17 | C�� | 22 | D�� | 34 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com