
| A. | KNO3 | B. | CO2 | C. | Fe | D. | C2H5OH |
科目:高中化学 来源: 题型:选择题
| A. | 萃取是常用的有机物提纯方法 | |
| B. | 燃烧法是研究确定有机物成分的有效方法之一 | |
| C. | 对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 | |
| D. | 核磁共振氢谱通常用于分析有机物的相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.08 | 0.08 |
| A. | 从反应开始直至60s和80s时,二氧化氮的平均反应速率是相等的 | |
| B. | 80s后将容器的体积缩小为1L,平衡向正反应方向移动,气体颜色变浅 | |
| C. | n1的范围是0.28<n1<0.33 | |
| D. | 升高温度,既能加快反应速率,也能提高N2O4的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③④ | C. | ②④⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸保存在玻璃瓶中 | B. | 金属钠保存在煤油中 | ||
| C. | 氧化钠保存在敞口容器中 | D. | 浓硫酸保存在橡胶塞试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8 g Na2O2与足量H2O反应,电子转移1.204×1023 NA个 | |
| B. | 16 g O2和O3的混合气体中,含O原子 NA个 | |
| C. | 1.12 L氯气中含有0.1 NA个氯原子 | |
| D. | 标准状况下,2.24 L水中含有0.1 NA个水分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2+I2(g)?2HI△H>0 | B. | N2+3H2?2NH3△H<0 | ||
| C. | 2SO3(g)?2SO2+O2△H>0 | D. | 4NH3+5O2(g)?4NO+6H2O(g)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
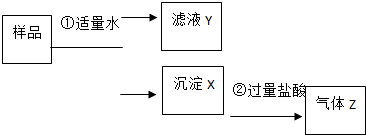 某固体物质是由NaOH、AlCl3、K2SO4、CaCO3、Ba(NO3)2 中的几种均匀混合而成,取样品进行如下实验(部分产物略去):
某固体物质是由NaOH、AlCl3、K2SO4、CaCO3、Ba(NO3)2 中的几种均匀混合而成,取样品进行如下实验(部分产物略去):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com