
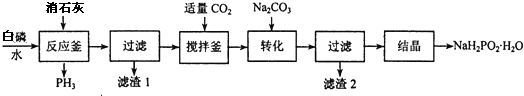
分析 白磷消石灰在反应釜中生成PH3和次磷酸二氢钙,过滤得到滤液通入适量二氧化碳除去过量的氢氧化钙,加入碳酸钠转化为次磷酸钠,结晶得到次磷酸钠晶体,
(1)根据化学平衡常数表达式完成;磷化氢是一种易燃在常温下催化氧化为磷酸的反应方程式;
(2)反应釜中另一种生成物为次磷酸二氢钙,过滤所得滤液呈碱性,通入二氧化碳中和过量的碱;加入碳酸钠,生成了碳酸钙沉淀,过滤后滤渣2碳酸钙;
(3)碱性条件下,次磷酸根离子被氧化为HPO32-的反应方程式.
解答 解:(1)4PH3(g)?P4(g)+6H2(g)反应的平衡常数表达式为:$\frac{{c}^{6}({H}_{2})c({P}_{4})}{{c}^{4}(P{H}_{3})}$;磷化氢是一种易燃、有毒的气体,可以在常温下催化氧化为磷酸,反应的化学方程式为:PH3+2O2$\frac{\underline{\;催化剂\;}}{\;}$H3PO4,
故答案为:$\frac{{c}^{6}({H}_{2})c({P}_{4})}{{c}^{4}(P{H}_{3})}$; PH3+2O2$\frac{\underline{\;催化剂\;}}{\;}$H3PO4;
(2)反应釜中另一种生成物为次磷酸二氢钙,白磷和氢氧化钙在水溶液中反应生成次磷酸二氢钙和PH3,反应的化学方程式为:2P4+3Ca(OH)2+6H2O=3Ca(H2PO2)2+2PH3↑,由于过滤后所得滤液呈碱性,通入二氧化碳用于中和过量的碱,上一步加入碳酸钠,生成了碳酸钙沉淀,过滤后滤渣2碳酸钙,
故答案为:2P4+3Ca(OH)2+6H2O=3Ca(H2PO2)2+2PH3↑;中和过量碱(或调节溶液pH或除去部分Ca2+离子);CaCO3;
(3)在碱性条件下,次磷酸根离子被氧化为HPO32-,反应的离子方程式为:Cu2++H2PO2-+3OH-═Cu+HPO32-+2H2O,
故答案为:Cu2++H2PO2-+3OH-═Cu+HPO32-+2H2O.
点评 本题考查了以黄磷(P4)为原料制备次磷酸钠晶体的工艺流程,关键在于对工艺流程的理解,和知识的迁移运用,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:5 | C. | 3:2 | D. | 3:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
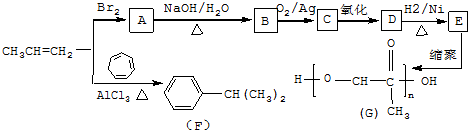
 ,C发生银镜反应的化学方程式
,C发生银镜反应的化学方程式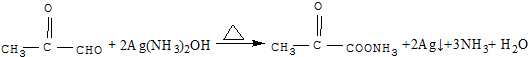 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
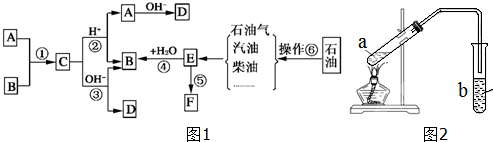
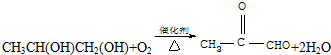
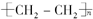 ?+3nO2$\stackrel{点燃}{→}$2nCO2+2nH2O.
?+3nO2$\stackrel{点燃}{→}$2nCO2+2nH2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑥ | C. | ⑤⑦ | D. | ⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
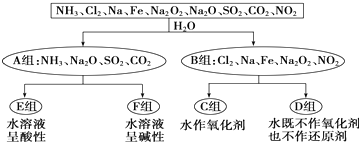
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| B. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| C. | N2(g)+3H2(g)═2NH3(g)△H<0,升高温度,反应速率v(H2 )和H2的平衡转化率均增大 | |
| D. | 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和石油的分馏都属化学变化 | |
| B. | 硫酸钡在医学上用作钡餐,钡离子对人体无害 | |
| C. | 碳-14可用作文物年代的鉴定,碳-14与碳-12互为同素异形体 | |
| D. | 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com