
【题目】如图是利用一种微生物将废水中的有机物(假设是淀粉)的化学能直接转化为电能,并利用此电能在铁上镀铜,下列说法中正确的是( ) 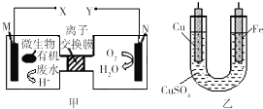
A.质子透过离子交换膜由右向左移动
B.铜电极应与X相连接
C.M电极反应式:(C6H10O5)n+7nH2O﹣24ne﹣═6nCO2↑+24nH+
D.当N电极消耗0.2 mol气体时,则铁电极增重16g
【答案】C
【解析】解:根据题给信息知,该装置是将化学能转化为电能的原电池,由甲图可知,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应,A.M是负极,N是正极,质子透过离子交换膜由左M极移向右N极,A错误;
B.铁上镀铜,则铁为阴极应与负极相连,铜为阳极应与正极Y相连,故B错误;
C.若有机废水中含有葡萄糖,葡萄糖属于燃料,在负极M上失电子发生氧化反应,电极反应式为C6H12O6+6H2O﹣24e﹣═6CO2↑+24H+ , 故C正确;
D、当N电极消耗0.2 mol氧气时,则转移0.2×4=0.8mol电子,所以铁电极增重 ![]() ×64=25.6g,故D错误.
×64=25.6g,故D错误.
故选C.
根据题给信息知,该装置是将化学能转化为电能的原电池,由甲图可知,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应,在铁上镀铜,则铁为阴极应与负极相连,铜为阳极应与正极相连,根据得失电子守恒计算,据此分析解答.


科目:高中化学 来源: 题型:
【题目】氮氧化铝(AlON)属原子晶体,是一种超强透明材料,可以由反应Al2O3+C+N2 ![]() 2AlON+CO合成,下列有关说法正确的是( )
2AlON+CO合成,下列有关说法正确的是( )
A.氮氧化铝中氮的化合价是﹣3
B.反应中氧化产物和还原产物的物质的量之比是1:2
C.反应中每生成5.7gAlON同时生成1.12LCO
D.AlON和CO的化学键类型不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2气体缓缓通入到含有等物质的量的KOH,Ba(OH)2和KAlO2的混合溶液中,直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示(假设每步反应均完全).下列关于整个反应进程中的各种描述不正确的是( ) 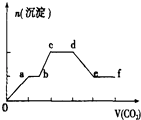
A.d~e段沉淀的减少是由碳酸钡固体的消失所致
B.b~c段反应的离子方程式是:2A1O2﹣+3H2O+CO2=2A1(OH)3↓+CO32﹣
C.0~a段反应的化学方程式是:Ba(OH)2+CO2=BaCO3↓+H2O
D.a~b段与c~d段所发生的反应相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的认识不正确的是( )
A.油脂在空气中完全燃烧转化为水和二氧化碳
B.蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
C.在水溶液里,乙酸分子中的-CH3可以电离出H+
D.在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数,下列叙述中正确的是( )
A.在标准状况下,1L庚烷完全燃烧后,所生成的气态产物的分子数为 ![]() NA
NA
B.1mol碳正离子CH5+所含的电子数为10NA
C.56g铁粉在1mol氯气中充分燃烧,失去的电子数为3NA
D.0.5molC3H8分子中含C﹣H共价键2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雯雯在自学碳酸钠性质时,查到了以下资料:
①CO2+Na2CO3+H2O=2NaHCO3 , CO2通入饱和碳酸钠溶液会产生白色沉淀,CO2不溶于饱和碳酸氢钠溶液。
②碳酸钠、碳酸氢钠在不同温度下的溶解度如表:
0 ℃ | 10 ℃ | 20 ℃ | 30 ℃ | |
Na2CO3 | 7.1 | 12.2 | 21.8 | 39.7 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 |
【进行实验1】验证CO2通入饱和碳酸钠溶液会产生白色沉淀
①配制碳酸钠溶液:取100 g 20 ℃的水,加入35 g碳酸钠固体,搅拌后,静置,取上层清液。
②利用装置一进行实验,连续5分钟向新制得的碳酸钠溶液中通入CO2。
【发现问题】实验中,始终没有看到沉淀现象,原因是什么呢?雯雯进行了以下实验探究。
【进行实验2】
实验操作 | 实验现象 |
①取100 g 20 ℃的水,加入35 g碳酸钠固体,搅拌后,静置,取上层清液 | 没有出现白色沉淀 |
(1)在0 ℃~30 ℃,Na2CO3和NaHCO3的溶解度受温度变化影响较大的是。
(2)大理石与稀盐酸反应的离子方程式为。
(3)装置二中饱和碳酸氢钠溶液的作用是。
(4)【进行实验3】
实验操作 | 实验现象 |
①取100 g热开水,加入35 g碳酸钠固体,完全溶解,再降温至20 ℃,取上层清液 | 装置一和装置二中的碳酸钠溶液中均出现白色沉淀 |
雯雯在最初的实验中没有看到沉淀现象的原因是。
(5)CO2通入饱和碳酸钠溶液会产生白色沉淀的原因是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2mol A与2mol B混合于2L的密闭容器中反应:2A(g)+3B(g)2C(g)+zD(g)若2s后,A的转化率为50%,测得v(D)=0.25molL﹣1s﹣1 , 下列推断正确的是( )
A.v(C)=0.2 molL﹣1s﹣1
B.z=3
C.B的转化率为25%
D.C的体积分数为28.6%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:SO2(g)+ ![]() O2(g)SO3(g)△H=﹣98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
O2(g)SO3(g)△H=﹣98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
A.98.32kJ
B.196.64kJ/mol
C.<196.64kJ
D.>196.64kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10L容器中,加入2mol的SO2(g)和2mol的NO2(g),保持温度恒定,发生反应:SO2(g)+NO2(g)SO3(g)+NO(g).当达到平衡状态时,测得容器中SO2(g)的转化率为50%.
试求:该温度下、该容器中,再继续加入1mol的SO2(g),则:
(1)化学平衡将向方向移动,NO2的转化率将(填“增大”、“不变”或“减小”);
(2)经计算,当达到新的平衡状态时,容器中SO2(g)的浓度是mol/L;
(3)整个过程中,SO2的转化率由50%变为%,NO2的转化率由%变为%.
(4)计算结果给我们的启示是:增大一种反应物物的用量,其转化率将(填“增大”、“不变”或“减小”)另一反应物的转化率将(填“增大”、“不变”或“减小”).现实生产中的意义是:可以通过增大的用量,来提高成本高的反应物的利用率.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com