
| A. | NaCl>NaF | B. | BaO>CaO | C. | H2S>H2O | D. | SiO2>CO2 |
分析 A、离子晶体中阴阳离子半径和越小,电荷越大,熔点越大;
B、离子晶体中阴阳离子半径和越小,电荷越大,熔点越大;
C、水分子间存在氢键,熔点异常的高;
D、二氧化硅是原子晶体,二氧化碳是分子晶体,原子晶体的熔点比分子晶体高.
解答 解:A、NaCl、NaF都是离子晶体,阴离子半径和大小顺序:Cl->F-,离子晶体中阴阳离子半径和越小,电荷越大,熔点越大;所以熔点高低顺序为:NaF>NaCl,故A错误;
B、BaO、CaO都是离子晶体,阳离子半径和大小顺序:Ba2+>Ca2+,离子晶体中阴阳离子半径和越小,电荷越大,熔点越大;所以熔点高低顺序为:BaO<CaO,故B错误;
C、水分子间存在氢键,熔点异常的高,所以熔点H2S<H2O,故C错误;
D、二氧化硅是原子晶体,二氧化碳是分子晶体,原子晶体的熔点比分子晶体高,所以熔点SiO2>CO2,故D正确;
故选D.
点评 本题考查晶体熔点的比较,明确不同类型晶体熔点的比较方法是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.2NA | |
| B. | 在反应KClO3+6HCl=KCl+3Cl2+3H2O中,每生成3molCl2转移的电子数为6NA | |
| C. | 含4molSi-O键的二氧化硅晶体中,氧原子数为2NA | |
| D. | 某密闭容器中盛有0.2molSO2和0.1molO2,在一定条件下充分反应,生成SO2的分子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X分子中所有原子可以处于同一平面 | |
| B. | Y可命名为邻苯二甲酸二乙酯 | |
| C. | 1mol荧光黄最多可与含3molNaOH的溶液完全反应 | |
| D. | 荧光黄中只有两种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.4g丙烷含有碳氢键的数目为NA | |
| B. | 3.9gNa2O2与足量CO2反应转移的电子数为0.1NA | |
| C. | 标准状况下,11.2LH2O中含有的分子数为0.5NA | |
| D. | 9.2gNO2和N2O4的混合气体中含有的氮原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,二氧化锰与浓盐酸不反应,而高锰酸钾与浓盐酸反应产生氯气 | |
| B. | 接触面相近的锌粒与1mo1•L-1的盐酸反应比1mo1•L-1的硫酸反应快 | |
| C. | 同质量的煤块在空气中燃烧比煤粉燃烧要慢 | |
| D. | 甲烷与氯气的混合气体在暗室中黄绿色变浅速率比在太阳照射下慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
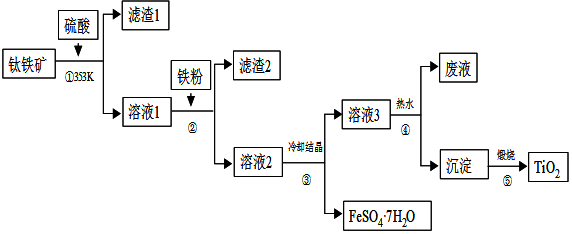
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱与盐酸反应 | B. | Ba(OH)2和H2SO4溶液反应 | ||
| C. | KOH溶液和亚硫酸溶液反应 | D. | NH4HSO4溶液和少量NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入铝粉能产生H2的溶液中:K+、Mg2+、Cl-、SO42- | |
| B. | 加入Na2O2的溶液中:K+、Al3+、Cl-、NO3- | |
| C. | 含有0.1mol•L-1Ca2+的溶液中:Na+、K+、CO32-、Cl- | |
| D. | 无色透明的酸性溶液中:MnO4-、K+、SO42-、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com