
【题目】下列关于胶体的叙述不正确的是
A. 胶体分散质的微粒直径在10-9 —10-7m之间
B. 用平行光照射胶体时,能产生丁达尔现象
C. 明矾产生的氢氧化铝胶体能够吸附水中杂质,达到净水目的
D. Fe(OH)3胶体是纯净物,能全部透过滤纸
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】A元素原子的L层比B元素原子的L层少3个电子,B元素原子核外电子数比A元素原子核外电子总数多5个,则A,B两元素形成的化合物可表示为( )
A.BA2
B.BA3
C.A3B2
D.B3A2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】14C是C的一种放射性核素,在高层大气中由宇宙射线产生的中子或核爆炸产生的中子轰击14N可使它转变为14C。下列说法正确的是
A. 14C核素的中子数为8 B. 14C原子最外层有6个电子
C. 14C和14N互为同位素 D. 14C16O2的质子数为46
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼可作为火箭发动机的燃料,与N2O4反应生成N2和水蒸气。已知:
①N2(g)+2O2(g) =N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g) = N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
(1)写出肼和N2O4反应的热化学方程式______________;
(2)上述反应中氧化剂是______________。
(3)火箭残骸中常现红棕色气体,当温度升高时,气体颜色变深,原因是存在如下反应:N2O4 (g) ![]() 2NO2 (g)
2NO2 (g)
① 上述反应的ΔH_________0(选填“>”或“<”)。
② 保持温度和体积不变向上述平衡体系中再充入一定量的N2O4,再次达到平衡时,混合气体中NO2的体积分数_______(填“增大”、“ 减小”或“不变”),混合气体的颜色_______(填“变深”或“变浅”)。
③一定温度下,将1 mol N2O4 充入一恒压密闭容器中发生上述反应,下列示意图正确且能说明反应达到平衡状态的是___________。
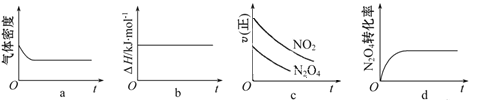
④若在相同温度下,上述反应改在体积为10L的恒容密闭容器中进行,反应3s后NO2的物质的量为0.6mol,则0-3s内的平均反应速率v(N2O4)=___________ mol·L-1·s-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对酸雨的叙述不正确的是
A. 酸雨是指pH<5.6的雨水
B. 化石燃料的过度使用是酸雨形成的主要原因
C. 飘尘在酸雨的形成过程中起到氧化剂的作用
D. 开发新能源是控制酸雨的重要措施之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。以卤块为原料可制得轻质氧化镁,工艺流程如图:
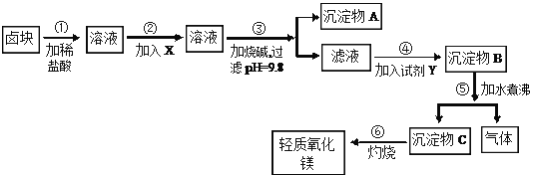
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1和表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH | 表2 化学试剂价格表 | ||||
物质 | 开始沉淀 | 沉淀完全 | 试剂 | 价格(元/吨) | |
Fe(OH)3 | 2.7 | 3.7 | 漂液(含25.2% NaClO) | 450 | |
Fe(OH)2 | 7.6 | 9.6 | 双氧水(含30% H2O2) | 2400 | |
Mn(OH)2 | 8.3 | 9.8 | 烧碱(含98% NaOH) | 2100 | |
Mg(OH)2 | 10.0 | 11.1 | 纯碱(含99.5% Na2CO3) | 600 | |
(1)在步骤②中加入的试剂X(从表2中选择)是_______而不是双氧水,其原因是_______________________。写出加入X发生反应的离子方程式_______________________。
(2)在步骤③中控制pH=9.8,其目的是____________________________。
(3)沉淀物A的成分为______________,试剂Y(从表2中选择)应该是_______。
(4)在步骤⑤中发生反应的化学方程式是________________________。
(5)若在实验室中完成步骤⑥,则沉淀物C必需在_______(填仪器名称)中灼烧。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( ) 
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q<W
C.原子半径:T>Q>R
D.W对应的单质只可以跟强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】参考下列图表和有关要求回答问题:
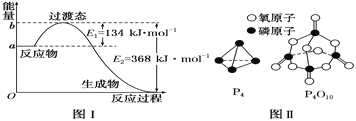
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E2的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。请写出NO2和CO反应的热化学方程式:_________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1
则甲醇燃烧生成液态水的热化学方程式:____________________________________
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O===O | P===O |
键能(kJ·mol-1) | 198 | 360 | 498 | x |
已知1 mol白磷(P4)完全燃烧放热为1194kJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=________ kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com