
【题目】化合物X(C12H13O4Br)是一种重要化工原料,存在如下转化关系:
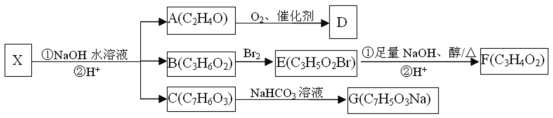
已知:①与官能团直接相连的碳原子称为α-C,α-C上的H称为α-H,易被取代。
②通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
根据以上信息回答:
(1)已知D能与碳酸氢钠反应生成二氧化碳,则D中官能团的名称是___,检验A物质是否完全反应可选用的试剂是__(填编号)。
①银氨溶液 ②氯化铁溶液 ③氢氧化钠的酚酞溶液 ④新制氢氧化铜的悬浊液
(2)B→E的反应类型是___________。
(3)已知F在一定条件下可以发生加聚反应生成高分子化合物,写出E和足量NaOH的醇溶液加热反应的化学方程式____。
(4)C的同分异构体中遇氯化铁溶液显紫色,且能发生银镜反应的物质共有____种,请任写一种物质的结构简式___。
【答案】羧基 ①④ 取代反应 CH3CHBrCOOH+2NaOH ![]() CH2=CHCOONa+NaBr+H2O 9
CH2=CHCOONa+NaBr+H2O 9 ![]()
【解析】
D能与碳酸氢钠反应生成二氧化碳,说明D为CH3COOH,A发生氧化变为D,则A为CH3CHO,根据B、E的分子式得出B到E发生取代反应,F在一定条件下可以发生加聚反应生成高分子化合物,E到F发生消去反应,则F为CH2=CHCOOH,E为CH3CHBrCOOH,B为CH3CH2COOH,C与碳酸氢钠反应,则C含有羧基。
(1)根据前面分析得到D为CH3COOH,则D中官能团的名称是羧基,检验A(CH3CHO)物质是否完全反应主要分析产物中是否含有乙醛,即用银氨溶液或新制氢氧化铜的悬浊液;故答案为:羧基;①④。
(2)根据BE分子式得到B→E的反应类型是取代反应;故答案为:取代反应。
(3) F在一定条件下可以发生加聚反应生成高分子化合物,F为CH2=CHCOOH,E和足量NaOH的醇溶液加热反应的化学方程式CH3CHBrCOOH+2NaOH![]() CH2=CHCOONa + NaBr + H2O;故答案为:CH3CHBrCOOH+2NaOH
CH2=CHCOONa + NaBr + H2O;故答案为:CH3CHBrCOOH+2NaOH![]() CH2=CHCOONa +NaBr+H2O。
CH2=CHCOONa +NaBr+H2O。
(4)C的同分异构体中遇氯化铁溶液显紫色,说明含有苯环和酚羟基,且能发生银镜反应,说明有醛基,可能是两个—OH和一个—CHO,当两个—OH在邻位,—CHO有2个位置即2种同分异构体,当两个—OH在间位,—CHO有3个位置即3种同分异构体,当两个—OH在对位,—CHO有1个位置即1种同分异构体;还可能一个—OH和一个—OOCH,邻间对三个,共9种,其中一种物质的结构简式![]() ;故答案为:9;
;故答案为:9;![]() 。
。


科目:高中化学 来源: 题型:
【题目】氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是
A.2Na2O2+2H2O =4NaOH+O2↑B.Cl2+ H2O![]() HClO + HCl
HClO + HCl
C.2F2+2H2O=4HF+O2D.4Fe(OH)2+O2+2H2O=4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向0.10mol/L的HCOONH4溶液中通入HCl或加入NaOH固体调节溶液pH(忽略溶液体积变化),部分粒子的浓度随pH的变化关系如图所示。其中[NH3]表示溶液中NH3与NH3·H2O的浓度之和,M点的坐标为(6.5,-4)。下列说法不正确的是
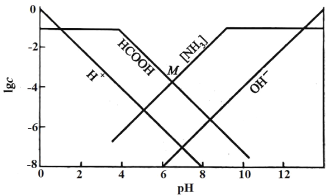
A.此温度下,Kw=1.0×10-14
B.pH<12时,溶液中[NH3]>c(OH-)
C.M点有c(HCOO-)>c(HCOOH)>c(NH4+)>c(H+)>c(OH-)
D.Ka(HCOOH)的数量级为10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入一定量SO2、O2发生反应2SO2(g)+O2(g)![]() 2SO3(g), 测得SO3浓度与反应温度关系如图.下列说法正确的是
2SO3(g), 测得SO3浓度与反应温度关系如图.下列说法正确的是

A. 该反应△H>0 B. SO2转化率:a>b>c
C. 化学反应速率:c>b>a D. 平衡常数K:b>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月9日,最新发现的第113号、115号、117号和118号元素终于有了中文名称

根据元素周期律知识,下列预测或说法肯定不合理的是( )
A. Nh的最高价氧化物对应的水化物的化学式为H3NhO3是一种强酸
B. Mc的最高价阳离子为Mc5+,氧化性比较弱
C. Og是第七周期中的最后一种元素,其原子序数是所有已发现元素中最大的
D. 根据金属和非金属的分界线,Ts的中文名称为“钿”可能更合理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒压密闭容器M(如图Ⅰ)和恒温恒容密闭容器N(如图Ⅱ)中,两容器中均加入a molA和a molB,起始时两容器体积均为VL,发生如下反应并达到化学平衡状态:2A(?)+ B(?)![]() xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是
xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是
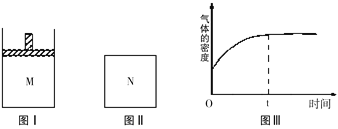
A. x=2
B. 若N中气体的密度如图Ⅲ所示,则A、B只有一种是气态
C. A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D. 若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中曲线表示短周期元素的原子序数(按递增顺序连续排列)及其常见最高化合价的关系,下列叙述不正确的是 ( )
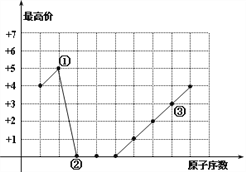
A. 单核简单离子半径大小为:②<③
B. ①、③可以按原子个数比1︰1形成化合物
C. ②、③形成的化合物是两性物质
D. ①、②形成的化合物的摩尔质量可能是44g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验题。实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如下图:
硫酸 化学纯(CP)
(500 mL)
品名:硫酸
化学式:H2SO4
相对分子质量:98
密度:1.84 g·cm-3
质量分数:98%
请回答下列问题:
(1)配制溶液时,一般可以分为以下几个主要步骤:
①量取 ②计算 ③溶解 ④定容 ⑤转移 ⑥洗涤 ⑦装瓶,其正确的操作顺序为________(填序号)。
(2)实验室只有100 mL、250 mL、500 mL三种规格的容量瓶,但要配制240 mL 0.1 mol·L-1的稀硫酸,需取该浓硫酸________ mL,计算所需浓硫酸的体积用到的公式___________。
(3)接下来完成此实验将用到的仪器有10 mL量筒、烧杯、玻璃棒、___________。
(4)要从所配溶液中取出50 mL盛装于试剂瓶中,给它贴上标签,则标签的内容是_________;若再从中取出10 mL溶液稀释至20 mL,则稀释后溶液的物质的量浓度为________。
(5)下列操作会使所配溶液浓度偏高的是____(填字母)。
A 转移溶液时未洗涤烧杯
B 定容时俯视容量瓶的刻度线
C 容量瓶用蒸馏水洗净后仍残留有蒸馏水
D 用量筒量取浓硫酸,读数时仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种应用广泛的金属,工业上用![]() 和冰晶石(
和冰晶石(![]() )混合熔融电解制得。
)混合熔融电解制得。
①铝土矿的主要成分是![]() 和
和![]() 等。从铝土矿中提炼
等。从铝土矿中提炼![]() 的流程如下:
的流程如下:
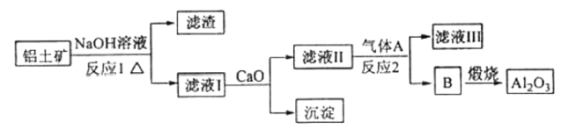
②以萤石(![]() )和纯碱为原料制备冰晶石的流程如下:
)和纯碱为原料制备冰晶石的流程如下:

请回答下列问题:
(1)写出反应1的化学方程式____________。
(2)滤液1中加入![]() 生成的沉淀是____________,反应2的离子方程式为____________(气体
生成的沉淀是____________,反应2的离子方程式为____________(气体![]() 过量)。
过量)。
(3)![]() 可作为建筑材料,化合物
可作为建筑材料,化合物![]() 是浓硫酸,请写出由
是浓硫酸,请写出由![]() 制备冰晶石的化学方程式____________。
制备冰晶石的化学方程式____________。
(4)电解氧化铝制铝时,以石墨为电极,请写出阳极的电极反应式____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com