
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
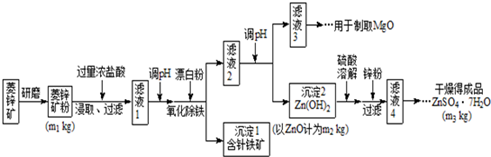
分析 菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,加入过量浓盐酸溶解,过滤除去不溶物,滤液中含有氯化锌、氯化铁、氯化亚铁、氯化镁、氯化钙及为反应的HCl,加入漂白粉将二价铁氧化为三价铁,调节pH得到氢氧化铁沉淀,过滤分离后,再调节滤液pH得到Zn(OH)2沉淀,且不能生成Mg(OH)2.氢氧化锌用硫酸溶解,用Zn粉除去过量的硫酸,将溶液蒸发、结晶、过滤后洗涤并干燥得到晶体.
(1)增大反应物接触面积,充分反应;
(2)组成元素是Fe、O、H,化学式量为89,其中铁的相对原子量为56,化学式中只能含有1个Fe原子、2个氧原子和1个氢原子;
(3)调节滤液pH得到Zn(OH)2沉淀,且不能生成Mg(OH)2;
(4)从“滤液3”制取MgO过程中,应先转化为Mg(OH)2,使用石灰乳最经济;
从溶液中获得干燥纯净的晶体一般有蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作;
(5)根据沉淀2中ZnO的质量利用关系式ZnCO3~ZnO计算菱锌矿粉中ZnCO3 的质量,可得菱锌矿粉中ZnCO3 的质量分数.
解答 解:菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,加入过量浓盐酸溶解,过滤除去不溶物,滤液中含有氯化锌、氯化铁、氯化亚铁、氯化镁、氯化钙及为反应的HCl,加入漂白粉将二价铁氧化为三价铁,调节pH得到氢氧化铁沉淀,过滤分离后,再调节滤液pH得到Zn(OH)2沉淀,且不能生成Mg(OH)2.氢氧化锌用硫酸溶解,用Zn粉除去过量的硫酸,将溶液蒸发、结晶、过滤后洗涤并干燥得到晶体.
(1)将菱锌矿研磨成粉,增大反应物接触面积,充分反应,提高浸取效率,
故答案为:增大反应物接触面积,使反应更加充分;
(2)组成元素是Fe、O、H,化学式量为89,其中铁的相对原子量为56,化学式中只能含有1个Fe原子、2个氧原子和1个氢原子,所以可能的组成为FeO(OH),
故答案为:FeO(OH);
(3)调节滤液2的pH得到Zn(OH)2沉淀而不生成Mg(OH)2,由Mg(OH)2开始沉淀时的pH、Zn(OH)2沉淀完全时的pH,pH应介于8.0≤pH<10.4,
故答案为:8.0≤pH<10.4;
(4)从“滤液3”制取MgO过程中,应先转化为Mg(OH)2,使用石灰乳最经济,
“滤液4”之后的操作目的是得到纯净的固体,应将溶液蒸发浓缩、冷却结晶、过滤、洗涤并干燥,
故答案为:B;蒸发浓缩、冷却结晶;
(5)菱锌矿转化可以得到m2 Kg ZnO,则:
ZnCO3~ZnO
125 81
m m2Kg
ZnCO3的质量m=$\frac{125{m}_{2}}{81}$Kg,ZnCO3的质量分数为$\frac{\frac{125{m}_{2}}{81}Kg}{{m}_{1}Kg}$=$\frac{125{m}_{2}}{{m}_{1}}$,
故答案为:$\frac{125{m}_{2}}{{m}_{1}}$.
点评 本题是物质制备工艺流程题,主要依据流程图中涉及的化学知识、化学原理来设计问题,(5)中注意过程中加入锌粉,不能利用硫酸锌晶体的质量计算,是对学生综合能力的考查.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 室温下,pH=3的溶液中:AlO2-、Al3+、Cl-、SO42- | |
| B. | 含有大量Fe3+的溶液中:K+、Mg2+、S2-、NO3- | |
| C. | 由水电离的c(H+)=10-11 mol•L-1的溶液中,K+、Na+、Cl-、SO42- | |
| D. | c(H+)<c(OH-)的溶液中:Na+、NH4+、CO32-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的0℃冰与0℃的水内能相同 | B. | 冰和可燃冰都是结晶水合物 | ||
| C. | 冰和干冰、水晶的空间结构相似 | D. | 氢键影响冰晶体的体积大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
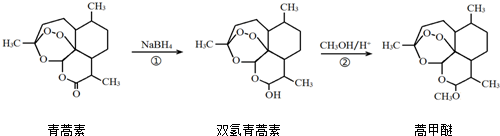
| A. | 青蒿素的分子式是C15H21O4 | |
| B. | 青蒿素在NaOH溶液中可以发生水解反应 | |
| C. | 反应②有H2O生成 | |
| D. | 反应①氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X | |
| B. | Y元素在周期表中的位置为第三周期第ⅣA族 | |
| C. | X分别与Y、Z、W所形成的化合物均为共价化合物 | |
| D. | X与Y所形成的化合物的沸点可能高于X与Z所形成的化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com