
【题目】某同学设计可如图所示的探究原电池的装置.下列有关说法正确的是( )
A.电极材料必须是金属材料
B.若a极为铜条、b极为锌片,c为蔗糖溶液时,灯泡会发亮
C.若a极为铝条、b极为铜片,c为浓硝酸溶液时,铜为负极
D.若a极为铝条、b极为镁片,c为稀硫酸溶液时,铝为负极
科目:高中化学 来源: 题型:
【题目】由二氧化硅制高纯硅的流程如下,下列判断中错误的是( )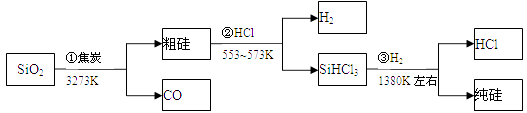
A.①②③均属于氧化还原反应
B.H2和HCl均可循环利用
C.SiO2是一种坚硬难熔的固体
D.SiHCl3摩尔质量为135.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏伽德罗常数的值,下列说法正确的是( )
A.7.8g苯中碳碳双键的数目为0.3NA
B.常温常压,11.2L CO和O2混合气体的原子数为NA
C.1molNO2溶于足量水中,转移电子的数目为NA
D.1.5g甲基所含有的电子数目为0.9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子在强酸性水溶液里能大量共存的是
A. Ba2+、Na+、CO32-、NO3- B. K+、 CH3COO-、I-、Fe3+
C. Cu2+、Fe2+、SO42-、Cl- D. K+、Cl-、NO3-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)可用作高温陶瓷复合材料,在航空航天、汽车发动机、机械等领域有着广泛的应用。由石英砂合成氮化硅粉末的路线如图所示。

其中—NH2中各元素的化合价与NH3相同。
请回答下列问题:
(1)石英砂不能与碱性物质共同存放,以NaOH为例,用化学方程式表示其原因:_________________。
(2)图示①~⑤的变化中,属于氧化还原反应的是________________。
(3)SiCl4在潮湿的空气中剧烈反应,产生白雾,军事工业中用于制造烟雾剂。SiCl4水解的化学方程式为_______________________________________。
(4)SiCl4和氨气在1400℃下可以制取氮化硅,反应化学方程式为___________________________。
(5)反应①的化学方程式为2C+ SiO2![]() Si+2CO↑,此反应中若碳充足,可能生成SiC和CO,写出该副反应的化学方程式_____________________________________,其中氧化剂和还原剂的物质的量之比为__________。
Si+2CO↑,此反应中若碳充足,可能生成SiC和CO,写出该副反应的化学方程式_____________________________________,其中氧化剂和还原剂的物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室在常温下将浓盐酸与高锰酸钾混合能够制氣气,反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O下列有关该反应的说法正确的是( )
A.KMnO4是还原剂
B.HCl是氧化剂
C.HCl中的氯元素得到电子
D.KMnO4中的Mn元素被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】施华洛世奇是全球首屈一指的精确切割仿水晶制造商,为时尚服饰、首饰、灯饰、建筑及室内设计提供仿水晶元素。水晶的主要成分是二氧化硅,二氧化硅是
A.混合物B.非金属单质C.氧化物D.有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关Na2CO3和NaHCO3的叙述中正确的是( )
A. 相同质量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体质量相同
B. Na2CO3比NaHCO3热稳定性强
C. Na2CO3和NaHCO3均可与澄清石灰水反应
D. Na2CO3和NaHCO3均不可与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产和生活中有广泛的应用.
(1)铁元素在元素周期表中的位置为 .
(2)等物质的量的铁分别与足量的盐酸、水蒸气在一定条件下反应,产生相同条件下的气体体积比为 ,铁在高温条件下与水蒸气反应的化学方程式为 .
(3)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图: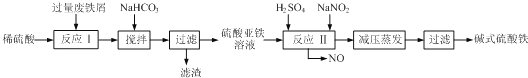
已知:常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe3+ | Fe2+ | Al3+ |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
①加入少量NaHCO3的目的是调节pH,应控制pH的范围为 .
②碱式硫酸铁溶于水后产生的[Fe(OH)2+]离子,可部分水解生成聚合离子[Fe2(OH)42+].该水解反应的离子方程式为 .
(4)高铁酸钾(K2FeO4)也是常用的水处理剂.它的制备方法有多种.
①熔融法又称为过氧化钠氧化法.先在高温熔融的条件下制备高铁酸钠:Fe+3Na2O2=Na2FeO4+2Na2O,再将高铁酸钠加入到氢氧化钾溶液里,发生反应:2KOH+Na2FeO4=K2FeO4+2NaOH,请根据复分解反应原理分析该反应发生的原因: .
②电解法制备高铁酸钾.铁和石墨分别做两个电极的电极材料,氢氧化钠溶液做电解液实现电解制备.阴极的电极材料为 , 写出阳极的电极反应式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com