
| A、绿色化学的核心是利用化学原理从源头上减少和消除工农业生产等对环境的污染 |
| B、大力开发和应用氢能源有利于实现“低碳经济” |
| C、吸烟不会造成室内PM2.5污染 |
| D、采用催化转换技术将汽车尾气中的NOx和CO转化为无毒气体 |


科目:高中化学 来源: 题型:
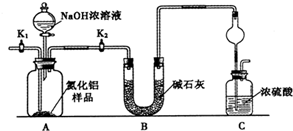
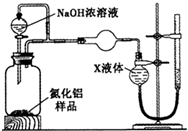
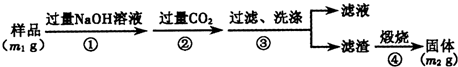
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、空气、SO2、NO、NO2 |
| B、KNO3溶液、Fe2+、H+、I- |
| C、NaHCO3溶液、Ca2+、OH-、Cl- |
| D、由水电离产生的c(H+)=10-11mol?L-1的溶液K+、SO42-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、简单离子半径:W>Z>Y |
| B、X与Y形成的化合物中,既含极性键又含非极性键的物质至少有2种 |
| C、Z与W形成的化合物一定是离子化合物 |
| D、Y的最高价氧化物对应的水化物的酸性一定比W的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、Pt电极是该装置的正极 |
| B、该电池发生的正极反应为:O2+4e-+2H2O=4OH- |
| C、负极的电极反应式:NO-2e-+O2-=NO2 |
| D、固体电解质中O2-向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(H+)>c(OH-) |
| B、c(Na+)=c(CH3COO-) |
| C、c(CH3COO-)>c(OH-) |
| D、c(Na+)<0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸的电离方程式为 H2CO3?2H++CO32- |
| B、乙酸钠的水解方程式 CH3COO-+H3O+?CH3COOH+H2O |
| C、偏铝酸钠和过量盐酸反应离子方程式AlO2-+4H+=Al3++2H2O |
| D、苯酚钠溶液中通入少量二氧化碳的离子方程式 2C6H5O-+CO2=2C6H5OH+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com