
分析 (1)6.02×1023个粒子的物质的量为1mol,说明RO4-所带电荷的物质的量为1mol,则其物质的量为1mol,据此可计算出RO42-的摩尔质量,再结合氧元素的摩尔质量计算出R的摩尔质量;
(2)设A的摩尔质量为M,依据n=$\frac{m}{M}$计算气体的物质的量,依据同温同压下,气体的体积之比等于物质的量之比计算解答;
(3)根据n=$\frac{V}{{V}_{m}}$=V$\frac{m}{M}$,先由体积计算混合气体的物质的量,结合二者的质量和摩尔质量、物质的量关系计算各自物质的量,进而可计算各种气体的质量、体积;
(4)无论NO和氧气是否完全反应,即无论容器中存在的微粒是什么,但密闭容器中各种元素原子个数不变,据此计算出反应后容器中氮原子和氧原子的个数之比.
解答 解:(1)6.02×1023个粒子的物质的量为1mol,说明RO4-所带电荷的物质的量为1mol,则其物质的量为1mol,RO42-的摩尔质量为:$\frac{99.5g}{1mol}$=99.5g/mol,则R的摩尔质量为:99.5g/mol-16g/mol×4=35.5g/mol,
故答案为:35.5g/mol;
(2)设A的摩尔质量为M,则2gA气体的物质的量n=$\frac{2}{M}$,二氧化碳的物质的量n′=$\frac{2}{44}$,同温同压下,气体的体积之比等于物质的量之比,所以MM$\frac{2}{44}$:$\frac{2}{M}$=120:165,解得M=32(g/mol),故答案为:32g/mol;
(3)设CO2、CO的物质的量分别为x、y,
则$\left\{\begin{array}{l}{x+y=\frac{11.2L}{22.4L/mol}}\\{44g/molx+28g/moly=18g}\end{array}\right.$,
x=0.25mol,y=0.25mol,
m(CO2)=0.25mol×44g/mol=11g,V(CO)=0.25mol×22.4L/mol=5.6L,
故答案为:11g;5.6L;
(4)无论NO和氧气是否完全反应,即无论容器中存在的微粒是什么,但密闭容器中各种元素原子个数不变,
根据N=nNA知,各种元素的原子个数之比等于其物质的量之比,n(N):n(O)=n(NO):[n(NO)+2n(O2)]=amol:(a+2b)mol=a:(a+2b),
故答案为:a:(a+2b).
点评 本题考查物质的量的相关计算,题目难度不大,明确“各种元素原子个数与是否发生反应无关”是解本题关键,根据原子守恒解答即可,试题培养了学生的化学计算能力.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 不纯物质(杂质) | 除杂试剂或分离方法 | 必用仪器 |
| A | 碘水 | 酒精、萃取 | 分液漏斗 |
| B | 二氧化碳(一氧化碳) | 点燃 | |
| C | 硝酸钾(氯化钠) | 直接蒸发结晶 | 蒸发皿 |
| D | 乙醇(水) | 生石灰、蒸馏 | 蒸馏烧瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
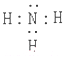 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
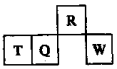 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中W所处的周期序数是最外层电子数的一半.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中W所处的周期序数是最外层电子数的一半.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 含T的盐溶液一定显酸性 | |
| D. | 实验室制备T的氢氧化物可以通过R形成的氢化物通入到T离子的溶液中得到 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某试样焰色反应呈黄色,则该试样一定是钠的化合物 | |
| B. | 在石油蒸馏装置中,将温度计水银球插入液面以下 | |
| C. | 在鸡蛋白溶液中加入浓的Na2SO4溶液,可使蛋白质变性 | |
| D. | 用结晶的方法分离氯化钠和硝酸钾的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
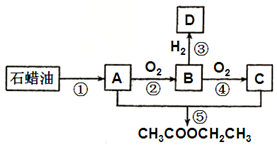 烃A是一种重要的化工原料.已知A在标准状况下的密度为1.25g•L-1,B可发生银镜反应.它们之间的转化关系如图:
烃A是一种重要的化工原料.已知A在标准状况下的密度为1.25g•L-1,B可发生银镜反应.它们之间的转化关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 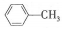 的一溴代物和 的一溴代物和 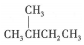 的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) | |
| B. | CH3CH=CHCH3分子中的四个碳原子在同一直线上 | |
| C. | 按系统命名法,化合物 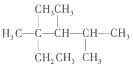 的名称是2,3,4-三甲基-2-乙基戊烷 的名称是2,3,4-三甲基-2-乙基戊烷 | |
| D. | 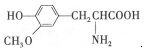 与 与 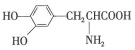 都是α-氨基酸且互为同系物 都是α-氨基酸且互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g N2含有的原子数为NA | |
| B. | 4gCa变成Ca2+失去的电子数为0.1NA | |
| C. | 1molO2的质量等于1mol O的质量 | |
| D. | 24gO2和24gO3所含有的原子数目相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com