
����Ŀ����֪�л�������Aֻ��̼��������Ԫ���������ʹ��ˮ��ɫ�������������������һ������ʯ�ͻ����ķ�չˮƽ��A��B��C��D��E�����¹�ϵ��
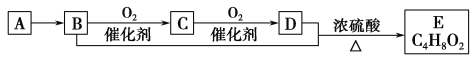
�������ƶϲ���ȷ����( )
A������A�ͼ����ѡ�����Ը��������Һ
B��D�к��еĹ�����Ϊ�Ȼ�������D���ʿ������ˮ���е�ˮ��
C������C�Ľṹ��ʽΪCH3CHO��E������Ϊ��������
D��B��D��E�Ļ�ѧ����ʽΪCH3CH2OH��CH3COOHCH3COOC2H5

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(AlN)��һ���������ǽ������ϣ�ijAlN��Ʒ������Al2O3���ʣ�Ϊ�ⶨAlN�ĺ������������ʵ�鷽����
(1)ʵ��ԭ����
AlN����Ũ��ǿ�����ɰ�������д��AlN��NaOH��Һ��Ӧ�Ļ�ѧ����_________��
(2)ʵ��װ�á�

��ͼCװ�������θ���ܵ�������_________________________��
(3)ʵ����̡�
�����Ӻ�ʵ��װ��________��Ȼ��Ƶ�Cװ�õ�����Ϊyg��
�ڳ�ȡxg AlN��Ʒ����Aװ����;���ý������ر�________��________(�K1����K2��);ͨ����Һ©������NaOHŨ��Һ�������ٲ������塣��K1��ͨ�뵪��һ��ʱ�䣬�Ƶ�Cװ�õ�������Ϊzg��ͨ�뵪����Ŀ����__________________��װ��B��������__________________________��
(4)���ݷ�����
��AlN����������Ϊ________��(���ԭ������Al��27��N��14)
������װ�ô���ȱ�ݣ����²ⶨ���ƫ�ߣ�������Ľ����________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.����ĥ�ڲ���ƿ����NaOH��Һ
B.ʹ������ƿ����100g 36%��NaCl��Һ
C.ϡ����ɳ�ȥ�Թ��ڱڵ�����
D.���ȿɳ�ȥNaHCO3�����л��е�Na2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ƹ�ҵ�����������������ж���ˮ�������ϸ�����ſ����ŷš���CN-��ˮ���ŷ�ǰ�Ĵ����������£�

��֪��9.0g����D�����������պ���8.0g��ɫ���壬���ɵ�����ͨ����������ʯ��ˮʱ������10.0g��ɫ���������õ��Ļ�������ȥ������ʣ���״�����ܶ�Ϊ1.25g/L�ĵ�������1.12L��
��1����ҺB��������_______________��������ԡ���ԭ�ԡ�����
��2��д������D�����������շ����Ļ�ѧ����ʽ___________________________________��
��3����ҺC�л���������CN-���ӣ�ͨ����Ӧ�ڣ��ɽ���ת��Ϊ�Ի����������ʣ��������ӷ���ʽ��ʾ��ԭ��_________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�����ͬһ��Һ�д������棬����һС���ƺ����ܴ���������ǣ�������
A.Na+��K+��Cl����CO32��
B.Cu2+��Na+��SO42����NO3��
C.Ba2+��K+��Cl����SO42��
D.K+��Na+��HCO3����CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о�������ȷ������ָ�����ϳɰ���Ӧ��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ�����
�� �ȣ��棩 | 360 | 440 | 520 |
Kֵ | 0.036 | 0.010 | 0.0038 |
��1�������ϱ����ݿ�֪�÷�ӦΪ_____ ������ȣ����ȣ���ȷ��������Ӧ��
�����д�ʩ������������ԭ��������_____������ţ���
a������ѹǿ�����ںϳɰ� b��ʹ�ú��ʵĴ��������ڿ������ɰ�
c����������Ҫ�����¶���500��C���� d����Ҫʹ�ù�����N2�����H2ת����
��2��0.2mol��������ˮ�����뺬��0.2mol�������Һ��Ӧ����QkJ���������Ȼ�ѧ����ʽ��ʾ�䷴Ӧʽ_____��
��3������ʱ����amol��������ˮ����ͨ��bmol�Ȼ��⣬��Һ���Ϊ1L����c��NH4+��=c��Cl��������һˮ�ϰ��ĵ���ƽ�ⳣ��Kb=_____����ab��ʾ����
��4��ԭ����H2��ͨ����Ӧ CH4��g��+H2O ��g��![]() CO��g��+3H2��g�� ��ȡ����֪�÷�Ӧ�У�����ʼ������е�
CO��g��+3H2��g�� ��ȡ����֪�÷�Ӧ�У�����ʼ������е�![]() �㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ����ͼ��ʾ��
�㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ����ͼ��ʾ��
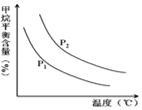
��ͼ�У��������߱�ʾѹǿ�Ĺ�ϵ�ǣ�P1_____P2�����������=����������
����������һ���������¶ȣ������IJ��ʻ�__�����������С����С�������䡱���䣩��
��5��ԭ����H2����ͨ����ӦCO��g��+H2O��g��![]() CO2��g��+H2��g����ȡ��
CO2��g��+H2��g����ȡ��
��T��ʱ�����ݻ��̶�Ϊ5L�������г���1molˮ������1mol CO����Ӧ��ƽ����CO��Ũ��Ϊ0.08molL��1�����¶��·�Ӧ��ƽ�ⳣ��KֵΪ_____��
�ڱ����¶���ΪT�����ݻ����Ϊ5L���ı�ˮ������CO�ij�ʼ���ʵ���֮�ȣ������������з�Ӧ�����������ܹ�˵����ϵ����ƽ��״̬����_____������ţ���
a��������ѹǿ����ʱ��ı�
b�����������ܶȲ���ʱ��ı�
c����λʱ��������a mol CO2��ͬʱ����a mol H2
d���������n��CO����n��H2O����n��CO2����n��H2��=1��16��6��6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ2NO2![]() 2NO��O2�ں����ܱ������н��У���������ﵽƽ��״̬����
2NO��O2�ں����ܱ������н��У���������ﵽƽ��״̬����
����λʱ��������n mol O2��ͬʱ����2n mol NO2
����������ƽ����Է����������ٸı�
��NO2��NO��O2�ķ�Ӧ����֮��Ϊ2��2��1
������������ɫ���ٸı�
�����������ܶȲ��ٸı�
A�������� B�����ۢ� C�������� D����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪AΪij�־ۼ���ϩ������ά(M)�ĵ�������ת����ϵ���£�

�ش��������⣺
(1)B�й����ŵĽṹ��ʽΪ_______________________��
C������________(ϵͳ����������)��
(2)��ӦA��M�ķ�Ӧ����Ϊ________��M�Ľṹ��ʽΪ________________��
(3)����ӦC��D�Ļ�ѧ����ʽΪ_____________________________________��
��F��������Һ��Ӧ�Ļ�ѧ����ʽΪ___________________________________��
(4)����E������˵����ȷ����________(��д���)��
������������̼ԭ�Ӷ���ͬһƽ����
������H2��Ӧ ������NaOH�Ĵ���Һ��Ӧ ������HBr��Ӧ
(5)д����������������A��ͬ���칹��Ľṹ��ʽ��________________��
����A������ͬ�Ĺ����� ��ˮ�����֮һ(��Է�������Ϊ108)��FeCl3��Һ����ɫ ���˴Ź���������5�ַ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.ij�¶��£���һ��10L�ĺ����ܱ������У�X��Y��Z��Ϊ���壬�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ��������գ�
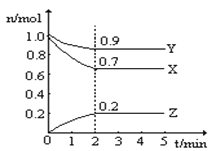
��1���÷�Ӧ�Ļ�ѧ����ʽΪ_____________ ��
��2����Ӧ��ʼ��2min��������Z��ʾ��ƽ����Ӧ����Ϊ_____________��
��.�ں��º��ݵ��ܱ������У����������������ٷ����仯ʱ��
�ٻ�������ѹǿ�ڻ��������ܶȢۻ������������ʵ����ܻ���������ɫ�ݻ�������ƽ����Է�����������Ӧ���������ķ�Ӧ����֮�ȵ��ڻ�ѧ������֮��
��1��һ����֤��2SO2(g)+O2(g) ![]() 2SO3(g)�ﵽƽ��״̬����_______������ţ���ͬ����
2SO3(g)�ﵽƽ��״̬����_______������ţ���ͬ����
��2��һ����֤��A(s)+2B(g) ![]() C(g)+D(g)�ﵽƽ��״̬����_______��
C(g)+D(g)�ﵽƽ��״̬����_______��
��. �� 6mol A���� �� 2mol B������2L�ܱ������л�ϲ���һ�������·�����Ӧ��
3A��g��+B��g��![]() xC��g��+2D��g��������5min��Ӧ�ﵽƽ��״̬�������ڵ�ѹǿ��С����֪D��ƽ����Ӧ����Ϊ0.2mol/��L��min��������д���пհף�
xC��g��+2D��g��������5min��Ӧ�ﵽƽ��״̬�������ڵ�ѹǿ��С����֪D��ƽ����Ӧ����Ϊ0.2mol/��L��min��������д���пհף�
��x����ֵΪ______��
��5minʱB��ת����Ϊ______��
���������¶ȣ�V��_________��������С������ȡ�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com