

| ||
| amol/L |
| m |
| 104 |
| ||
| amol/L |
| 50m |
| 13a |
| 50m |
| 13a |
| 7.9g |
| 13.1g |


科目:高中化学 来源: 题型:
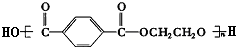
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用加热的方法除去Na2CO3固体中混有NaHCO3 |
| B、可向NaHCO3溶液中通入过量的CO2气体除去其中混有的Na2CO3 |
| C、可用澄清石灰水鉴别NaHCO3和Na2CO3两种溶液 |
| D、向饱和Na2CO3溶液中通入过量的CO2气体,溶液最终有晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不能透过滤纸 |
| B、有关丁达尔效应 |
| C、不能透过半透膜 |
| D、在外加电场的作用下可能向某一极作定向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铜绿的主要成分是碱式碳酸铜 | 可用稀盐酸除铜器表面的铜绿 | Ⅰ对;Ⅱ对;无 |
| B | 铜表面易形成致密的氧化膜 | 铜制容器可以盛放浓硫酸 | Ⅰ对;Ⅱ对;有 |
| C | 向硫酸铜溶液通入氨气,有深蓝色沉淀产生,过滤后灼烧滤渣,最后变成黑色固体 | 把铜丝放在酒精灯火焰上灼烧,铜丝表面变黑 | Ⅰ对;Ⅱ对;有 |
| D | 蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 | 硫酸铜溶液可用作游泳池的消毒剂 | Ⅰ错;Ⅱ对;无 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

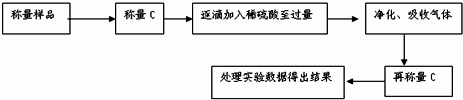

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com