
【题目】下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A. Fe + CuSO4 = FeSO4+ Cu
B. AgNO3+ NaCl= AgCl↓ + NaNO3
C. MnO2 + 4 HCl(浓) ![]() MnCl2+ Cl2↑ + 2 H2O
MnCl2+ Cl2↑ + 2 H2O
D. 2KMnO4 ![]() K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】乙烯醚是一种麻醉剂,其合成路线如图,有关说法正确的是( )
![]()
A. X可能是Br2B. X可能为HO﹣Cl
C. 乙烯醚易溶于水D. ①②③反应类型依次为取代、取代和消去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过如下流程制备氧化亚铜:

已知CuCl难溶于水和稀硫酸:Cu2O+2H+==Cu2++Cu+H2O
下列说法不正确的是
A. 步骤②SO2可用Na2SO3替换
B. 步骤③中为防止CuCl被氧化,可用SO2水溶液洗涤
C. 步骤④发生反应的离子方程式为2CuCl+2OH-=Cu2O+2Cl-+H2O
D. 如果Cu2O试样中混有CuCl和CuO杂质,用足量稀硫酸与Cu2O试样充分反应,根据反应前、后固体质量可计算试样纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法和解释错误的是
A. 冰融化时,需破坏晶体中的全部氢键,所以冰融化时密度变大
B. 卤化物![]() 从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
C. 由于石墨晶体中层间距较远,电子不易实现迁移,所以石墨的导电性只能沿石墨平面的方向
D. 金属中的“电子气”在电场中可以定向移动,所以金属具有良好的导电性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.4 mol某气体的体积为9.8 L,则该气体的摩尔体积为____________。
(2)有标准状况下的四种气体:①6.72 L CH4,②3.01×1023个H2分子,③3.4 g H2S,④0.2 mol NH3,则其体积按从大到小的顺序为:_________________(填序号)。
(3)标准状况下,测得1.92克某气体的体积为672 mL,则此气体的相对分子质量为__________
(4)实验室用Na2CO3·10H2O晶体配制0.5mol/L的Na2CO3溶液970mL,应称取Na2CO3·10H2O的质量是___________。
(5)某学生欲用12mol·L-1浓盐酸和蒸馏水配制500 mL 0.3 mol·L-1的稀盐酸。
①该学生需要量取________mL上述浓盐酸进行配制。
②下列实验操作会导致所配制的稀盐酸的物质的量浓度偏小的是__________(填序号)。
a.用量筒量取浓盐酸时俯视观察凹液面
b.将量取浓盐酸的量筒进行洗涤,并将洗涤液转移到容量瓶中
c.稀释浓盐酸时,未冷却到室温即转移到容量瓶中
d. 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
e.容量瓶洗涤干净后未干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(加试题)三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,常用于制作重要的电子元件材料和蓄电池材料。某实验室尝试用工业废弃的NiO催化剂(还含有Fe2O3、CaO、CuO、BaO等杂质)为原料生产2NiOOHH2O沉淀,继而制备Ni2O3。实验工艺流程为:
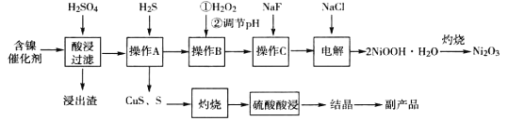
已知:①有关氢氧化物开始沉淀和沉淀完全的pH如表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 |
沉淀完全的pH | 3.6 | 9.7 | 9.2 |
②常温下CaF2难溶于水,微溶于无机酸
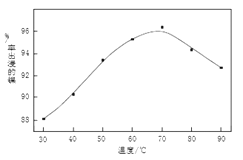
(1)操作B中需调节pH范围为____,使用Na2CO3调节pH过程中发生的反应有___。实验人员发现温度不同时,镍的浸出率不同,浸出率与温度的关系如图所示。请解释当温度高于70℃时,浸出液中Ni2+含量降低的原因____。
(2)下列说法正确的是____
A.为提高酸浸效率,可充分搅拌或适当提高硫酸浓度
B.操作A中应持续通入过量H2S气体使杂质Cu2+彻底沉淀
C.浸出渣的主要成分为CaSO42H2O和BaSO4
D.为得到副产品胆矾,应蒸发浓缩至出现大量晶体,用玻璃纤维代替滤纸进行趁热过滤
(3)电解过程中,Cl-在阳极被氧化为ClO-,但是反应前后溶液中Cl-浓度不变。写出生成沉淀反应的离子方程式_____。
(4)操作C加入NaF后如何证明沉淀完全____。
(5)工业上也可通过将草酸镍(NiC2O42H2O)在热空气中干燥脱水,再在高温下煅烧三小时制得Ni2O3,同时获得混合气体。草酸镍受热分解的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题
(1)用一种试剂除去下列物质中的杂质(括号内物质为杂质,所用试剂均为适量),写出所加的试剂及有关反应的离子方程式。
①FeSO4溶液(CuSO4):试剂___离子方程式___。
②Cu(Mg):试剂___,离子方程式___。
(2)写出下列反应的离子方程式
①氯化铁溶液与氢氧化钠溶液的反应___;
②常用澄清石灰水检验CO2气体___;
③用小苏打片(NaHCO3)治疗胃酸过多___。
(3)用双线桥标出下列反应中电子转移的方向和数目。___
Cl2+SO2+2H2O=H2SO4+2HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3是中学实验室常用的试剂,可以用来制备氢氧化铁胶体。
(1)下列制备氢氧化铁胶体的操作方法正确的是____________(填字母);
a.向饱和氯化铁溶液中滴加少量的氢氧化钠稀溶液
b.加热煮沸氯化铁饱和溶液
c.![]() 氨水中滴加氯化铁浓溶液
氨水中滴加氯化铁浓溶液
d.在沸水中滴加饱和氯化铁溶液,煮沸至液体呈红褐色
(2)写出制备氢氧化铁胶体的离子方程式__________________________;
(3)下列与胶体性质无关的是_____________(填字母);
a.河流入海口处形成沙洲
b.使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血
c.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
d.在饱和氯化铁溶液中滴加NaOH溶液,产生红褐色沉淀
e.冶金厂常用高压电除去烟尘
(4)从溶液中分离提纯Fe(OH)3胶体的方法叫_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某次实验需用0.4 mol/LNaOH溶液480mL。配制方法如下:
(1)配制该溶液应选用________mL容量瓶;
(2)用托盘天平准确称量________g固体NaOH,应放在________(仪器)中称量。
(3)将称量好的NaOH固体放在500mL大烧杯中,倒入约100mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待______________后,将烧杯中的溶液注入容量瓶中;
(4)用少量蒸馏水洗涤烧杯________次,洗涤后的溶液_______________,轻轻晃动容量瓶,使溶液混合均匀;
(5)向容量瓶中加入蒸馏水,到液面接近刻度线__________时,改用_________加蒸馏水至液面最低点与刻度线相切。盖好瓶塞,上下颠倒混合均匀;
(6)若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏高的是________,偏低的是________,对实验结果没有影响的是____________(填各选项的序号)。
A.所用的NaOH中混有少量Na2CO3
B.用带有生锈砝码的托盘天平称量一定质量固体NaOH
C.配制溶液所用的容量瓶洗净后没有烘干
D.固体NaOH在烧杯中溶解后立即将溶液转移到容量瓶内并接着进行后续操作
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
F.最后确定NaOH溶液体积(定容)时,俯视观察液面与容量瓶刻度线
G.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com