
| A. | 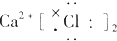 | B. | 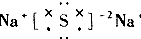 | C. | 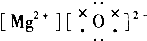 | D. | 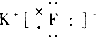 |
分析 A.氯离子表示错误,且氯化钙的电子式中两个氯离子分别写在镁离子两边;
B.硫化钠为离子化合物,硫离子带2个负电荷,为2-;
C.氧化镁中,镁离子带正电,不需要中括号;
D.氯化钾是离子化合物.
解答 解:A.氯化钙为离子化合物,氯离子需要标出电荷,且分别写在镁离子两边,正确的电子式为: ,故A错误;
,故A错误;
B.硫化钠为离子化合物,硫离子带2个负电荷,硫化钠的电子式为: ,故B错误;
,故B错误;
C.氧化镁中,镁离子带正电,不需要中括号,氧化镁的电子式为: ,故C错误;
,故C错误;
D.氯化钾为离子化合物,其电子式为: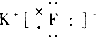 ,故D正确;
,故D正确;
故选D.
点评 本题考查了电子式、结构式的表示方法,题目难度中等,注意掌握电子式、结构式的概念及表示方法,明确离子化合物与共价化合物的电子式的区别.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:填空题
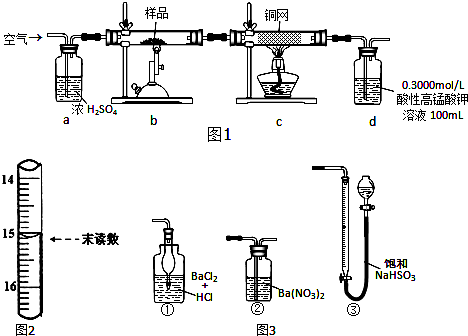
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋可除去热水壶内壁的水垢 | |
| B. | 淀粉,油脂和蛋白质都是高分子化合物 | |
| C. | 乙醇、乙酸均能与Na反应放出H2,但二者分子中官能团不同 | |
| D. | 甲烷和Cl2的反应与乙烯和Br2的反应不属于同一类型的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
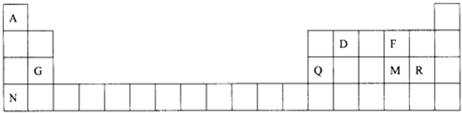
 .
.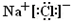 ,Na在F单质中燃烧的产物是Na2O2.
,Na在F单质中燃烧的产物是Na2O2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x的原子半径大于y的原子半径 | |
| B. | x的第一电离能小于y 的第一电离能 | |
| C. | x的金属性大于y的金属性 | |
| D. | x的电负性大于y的电负性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来 | |
| D. | 国际上规定,0.012kg碳原子所含有的碳原子数目为1摩 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com