
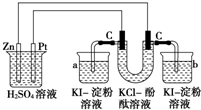
 按照如图接通线路,反应一段时间后,回答下列问题(假设所提供的电能可以保证电解反应的顺利进行):
按照如图接通线路,反应一段时间后,回答下列问题(假设所提供的电能可以保证电解反应的顺利进行):分析 第一个装置能自发的进行氧化还原反应,则为原电池,Zn易失电子作负极、Pt作正极,B为电解池,左边C为阳极,阳极上电极反应式为2Cl--2e-=Cl2↑、阴极反应式为2H2O+2e-=H2↑+2OH-,a中发生反应2KI+Cl2═2KCl+I2,碘遇淀粉试液变蓝色,b中有无色气体生成,淀粉碘化钾溶液不变色,据此分析解答.
解答 解:(1)第一个装置能自发的进行氧化还原反应,则为原电池,Zn易失电子作负极、Pt作正极,B为电解池,左边C为阳极,阳极上电极反应式为2Cl--2e-=Cl2↑、阴极反应式为2H2O+2e-=H2↑+2OH-,a中发生反应2KI+Cl2═2KCl+I2,碘遇淀粉试液变蓝色,故答案为:a烧杯中溶液变蓝;
(2)U形管内阳极上电极反应式为2Cl--2e-=Cl2↑、阴极反应式为2H2O+2e-=H2↑+2OH-,反应方程式为2KCl+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2KOH,
故答案为:2KCl+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2KOH;
(3)Zn易失电子作负极、Pt作正极,大烧杯中负极反应式Zn-2e-=Zn2+,故答案为:Zn-2e-=Zn2+;
(4)如果烧杯中有0.508g碘析出,析出碘的物质的量=$\frac{0.508g}{254g/mol}$=0.002mol,转移电子的物质的量=2×0.002mol=0.004mol,串联电路中转移电子相等,所以消耗Zn的质量=$\frac{0.004mol}{2}$×65g/mol=0.13g,
故答案为:0.13.
点评 本题考查原电池和电解池原理,明确各个电极上发生的反应是解本题关键,同时考查学生分析问题、解答问题能力,知道常见物质的性质,注意串联电路中转移电子相等,题目难度不大.


科目:高中化学 来源: 题型:选择题
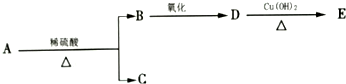 分子式为C9H18O2的有机物A有下列转化关系:其中B、C的相对分子质量相等,则A的可能的结构简式有( )
分子式为C9H18O2的有机物A有下列转化关系:其中B、C的相对分子质量相等,则A的可能的结构简式有( )| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 臭氧与空气中的氮氧化合物发生作用后会产生光化学烟雾,对人体健康、植物成长等都有很大危害 | |
| B. | 农业废弃物、城市与工业有机废弃物及动物粪便中都蕴藏着丰富的生物质能 | |
| C. | 分光光度计可用于分析溶液颜色与反应物(或生成物哪个)浓度的关系,从而确定化学反应速率 | |
| D. | 某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7种 | B. | 6种 | C. | 5种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
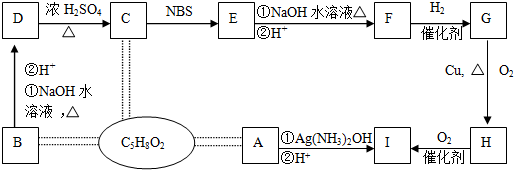
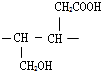 ;
;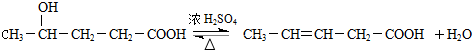 ;
;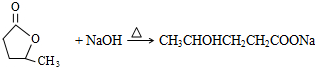 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 共得到0.96g硫 | B. | 通入H2S的体积为336mL | ||
| C. | 硫元素先被还原后被氧化 | D. | 转移电子总数为3.0×10-2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2既是氧化产物又是还原产物 | |
| B. | NH4+部分被氧化 | |
| C. | 氧化产物和还原产物的物质的量比为3:1 | |
| D. | 氧化产物和还原产物的物质的量比为1:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com