
【题目】Ⅰ.用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20mL 0.1mol·L-1H2C2O4溶液 | 30mL 0.1 mol·L-1KMnO4溶液 |
② | 20mL 0.2mol·L-1H2C2O4溶液 | 30mL 0.1mol·L-1KMnO4溶液 |
(1)该实验探究的是____因素对化学反应速率的影响。如图一,相同时间内针筒中所得的CO2体积大小关系是___(填实验序号)。

(2)若实验①在2min末收集了2.24mLCO2(标准状况下),则在2min末,c(MnO4-)___ mol·L-1(假设混合液体积为50mL)。
(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定___来比较化学反应速率。
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是①产物MnSO4是该反应的催化剂、②_____。
Ⅱ.一定温度下,将一定量的N2和H2充入固定体积的密闭容器中进行反应:
N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
(1)下列描述能说明该可逆反应达到化学平衡状态的有___。
A.容器内的压强不变
B.容器内气体的密度不变
C.相同时间内有3mol H-H键断裂,有6mol N-H键形成
D.c(N2):c(H2):c(NH3)=1:3:2
E.NH3的质量分数不再改变
(2)若起始时向容器中充入10mol ·L-1的N2和15mol ·L-1的H2,10min时测得容器内NH3的浓度为1.5mol ·L-1。10min内用N2表示的反应速率为___;此时H2的转化率为___。
【答案】浓度 ②>① 0.0596mol/L 测定生成相同体积的CO2所需时间或相同时间内KMnO4溶液颜色变化的程度 该反应放热 AE 0.075mol/( L·min) 15%
【解析】
Ⅰ.(1)①和②实验中,KMnO4溶液的浓度和体积均相同,但H2C2O4溶液的浓度不同,所以该实验探究的是浓度对化学反应速率的影响。由于②中草酸的浓度大于①中草酸的浓度,所以相同时间内针筒中所得的CO2体积②大于①;
(2)若实验①在2min末收集了标准状况下2.24mLCO2(即1×10-4mol),根据化学方程式,消耗的MnO4-为2×10-5mol,原有MnO4-的物质的量为0.003mol,则在2min末,剩余的MnO4-的物质的量为2.98×10-3mol,c(MnO4-)=2.98×10-3mol/0.05L=0.0596mol/L;
(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定生成相同体积的CO2所需时间或相同时间内KMnO4溶液颜色变化的程度来比较化学反应速率;
(4)反应开始时反应速率增大,可能的原因除了产物MnSO4是该反应的催化剂外,还可能是由于反应放热,温度升高,使反应速率增大;
Ⅱ.(1)A.此反应是反应前后气体分子数不相等的反应,所以当容器内的压强不变时,混合气的总物质的量不变,达到了平衡状态,故A正确;
B.气体密度等于混合气的总质量除以容器体积,此反应的反应物和生成物都是气体,根据质量守恒,混合气的总质量是不变的,而容器的体积也是固定的,所以容器内气体的密度一直不变,所以混合气的密度不变不能作为此反应达到平衡状态的判断依据,故B不正确;
C.相同时间内有3mol H-H键断裂,必然有6mol N-H键形成,故C不正确;
D.平衡时,各物质的物质的量浓度不再改变,而不是各物质的浓度之比等于方程式的系数比,故c(N2):c(H2):c(NH3)=1:3:2不能作为达到平衡状态的判断标准,故D不正确;
E.平衡时,各物质的质量分数都不再变化,所以NH3的质量分数不再改变可以作为达到平衡的判断标准,故E正确;
故选AE。
(2)若起始时向容器中充入10mol ·L-1的N2和15mol ·L-1的H2,10min时容器内NH3的浓度为1.5mol ·L-1。即NH3的浓度增加了1.5mol ·L-1,所以N2的浓度变化量为0.75mol ·L-1,10min内用N2表示的反应速率为![]() =0.075mol/( L·min);NH3的浓度增加了1.5mol ·L-1,所以反应的H2为2.25mol ·L-1,此时H2的转化率为
=0.075mol/( L·min);NH3的浓度增加了1.5mol ·L-1,所以反应的H2为2.25mol ·L-1,此时H2的转化率为![]() ×100%=15%。
×100%=15%。


科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算。
(1)含0.4 mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是___________。
(2)___________molH2O2所含原子数与0.2molH3PO4所含原子数相等。
(3)某硫酸钠溶液中含有3.01×1022个Na+,则溶液中SO42-的物质的量是___________。
(4)质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是____________。
(5)现有mg某气体,它是三原子分子,其摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,请用以上符号及相应数字填写下列空格。
①该气体的物质的量为___________mol。
②该气体所含原子总数为___________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇在工业中有广阔的用途
已知:①2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l) △H=-a kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-b kJ·mol-1
(1)反应2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(1)的△H=___________。
(2)CH3OH不充分燃烧时,生成C、CO和CO2以及气态水,将所有的产物通入一个10L的密闭容器中,在一定条件下发生可逆反应:
CO(g)+ H2O(g)![]() CO2(g)+H2(g) △H>0
CO2(g)+H2(g) △H>0
①有利于提高CO平衡转化率的条件是___________。(填正确答案标号)
A.高温 B.低温 C.低压 D.高压
②下列事实能说明该反应达到平衡的是___________。(填正确答案标号)
A.体系中的颜色不发生变化 B. v正(CO)/v逆(H2)=1
C.c(CO)/c(H2)=1 D.CO2的浓度不再发生变化
③向该密闭容器中充入2 mol CO,4.8molH2O。在200℃下,20分钟后达到平衡,测得CO的转化率为60%,v(CO2)=___________;该温度下的平衡常数是___________。
(3)在加热条件下用甲醇气相法制备CO和H2时,常采用加NiO作催化剂。发生2CH3OH(l)![]() 2CO(g)+4H2(g) △H>0,日产量与温度的关系如图所示。
2CO(g)+4H2(g) △H>0,日产量与温度的关系如图所示。
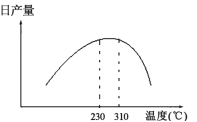
①保证较高日产量的适宜温度是______________;
②310℃以后日产量下降的原因可能是___________。
(4)21世纪甲醇燃料电池是最佳动力源之一。甲醇空气电池成为了车载电池,该燃料电池工作时的电池反应:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(1)。原理如图
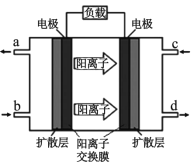
①c处应通入_________________________________;
②该电池的负极反应式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种重要的金属,以钛铁矿[主要成分为钛酸亚铁(FeTiO3),还含有少量Fe2O3]为原料制备钛的工艺流程如图所示。

(1)滤液1中钛元素以TiO2+形式存在,则“溶浸”过程发生的主要反应的化学方程式为________。
(2)物质A为________(填化学式),“一系列操作”为________。
(3)“水解”步骤中生成TiO2·xH2O,为提高TiO2·xH2O的产率,可采取的措施有________、________。(写出两条)。
(4)“电解”是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。阴极的电极反应式为________;若制得金属Ti 9.60g,阳极产生气体________mL(标准状况下)。
(5)将少量FeSO4·7H2O溶于水,加入一定量的NaHCO3溶液,可制得FeCO3,写出反应的离子方程式________;若反应后的溶液中c(Fe2+)=2×10-6mol·L-1,则溶液中c(CO32-)=________mol·L-1。(已知:常温下FeCO3饱和溶液浓度为4.5×10-6mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,xA+yB![]() zC的反应达到平衡。
zC的反应达到平衡。
(1)已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z之间的关系是__________________;
(2)已知C是气体,且x+y=z,在增大压强时,如果平衡发生移动,则平衡一定向_____________移动;
(3)已知B、C是气体,当其他条件不变,增大A的物质的量时,平衡不发生移动,则A是_____________态物质。
(4)若加热后C的质量分数减少,则正反应是_________(填“放热”或“吸热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下。

请回答下列问题:
(1)F的化学名称是________,⑤的反应类型是________。
(2)E中含有的官能团是________(写名称),D聚合生成高分子化合物的结构简式为________。
(3)将反应③得到的产物与O2在催化剂、加热的条件下反应可得D,写出反应④的化学方程式________。
(4)④、⑤两步能否颠倒?________(填“能”或“否”)理由是________。
(5)与A具有含有相同官能团的芳香化合物的同分异构体还有________种(不含立体异构),其中核磁共振氢谱为六组峰,且峰面积之比为1:1:2:2:2:2的结构简式为________。
(6)参照有机物W的上述合成路线,以M和CH3Cl为原料制备F的合成路线(无机试剂任选)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+2D(g)中,表示该反应速率最快的是( )
3C(g)+2D(g)中,表示该反应速率最快的是( )
A. υ(A)=0.5 mol/(L·s) B. υ(B)=0.3 mol/(L·s)
C. υ(C)=0.8 mol/(L·s) D. υ(D)=1 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.硫是一种不溶于水的淡黄色固体
B.硫与非金属反应时一定作还原剂
C.硫与铁反应时生成硫化铁
D.硫在自然界中仅以化合态存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com