
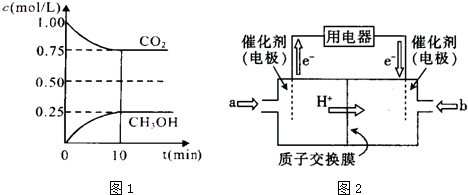
分析 (1)①化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断;
②根据图象数据结合平衡常数K的计算公式进行计算,根据K仅与温度有关及反应为放热来判断改变条件;
(2)①根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应;
②根据电池反应为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-,结合两极生成气体体积计算;
(3)已知①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1;②CH3OH(g)=CH3OH(l)△H=-b kJ•mol-1;③2H2(g)+O2(g)=2H2O(g)△H=-c kJ•mol-1;④H2O(g)=H2O(l)△H=-d kJ•mol-1,根据盖斯定律,将已知热化学方程式按照$\frac{3}{2}$③+2×④-①-②可得目标反应.
解答 解:(1)①A.CO2的体积分数在混合气体中保持不变,则能说明达到平衡状态,故A正确;
B.该反应过程中气体的体积发生变化,则反应过程中压强为变量,当氧混合气体的压强不随时间的变化而变化,说明正逆反应速率相等,达到平衡状态,故B正确;
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O,不能体现正逆反应,故不能说明达到平衡状态,故C错误;
D.H2O与CH3OH都是产物,并且按照1:1的比例生成,所以H2O与CH3OH的物质的量浓度之比始终为1:1,不能说明达到平衡状态,故D错误;
故答案为:AB;
②由图象数据CO2(g)+3H2(g)?CH3OH(g)+H2O(g)得
开始浓度:1 1.5 0 0
转化浓度:0.25 0.75 0.25 0.25
平衡浓度:0.75 0.75 0.25 0.25
所以该稳定性该反应的平衡常数为:K=$\frac{0.25×0.25}{0.75×0.7{5}^{3}}$=0.20;则要使平衡常数K=1,又反应放热所以降低温度使平衡向正反应方向移动,故C正确,
故答案为:0.20;C;
(2)(4)①根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,负极反应式为 CH3OH-6e-+H2O=CO2+6H+,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O,
故答案为:负;CH3OH-6e-+H2O=CO2+6H+;
②用此电池以惰性电极电解饱和食盐水的电池反应为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-,当两极共收集到标准状况下的气体1.12L(0.05mol)时,则生成氢氧化钠的物质的量是0.05mol,所以C(OH-)=$\frac{0.05mol}{0.5L}$=0.1mol/L,所以pH=13,
故答案为:13;
(3)已知①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
②CH3OH(g)=CH3OH(l)△H=-b kJ•mol-1
③2H2(g)+O2(g)=2H2O(g)△H=-c kJ•mol-1
④H2O(g)=H2O(l)△H=-d kJ•mol-1
根据盖斯定律,$\frac{3}{2}$③+2×④-①-②可得,CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=$\frac{3}{2}$(2c kJ•mol-1)+(-d kJ•mol-1)×2-(-a kJ•mol-1)-(-b kJ•mol-1)=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1,
所以CH3OH(l)燃烧热的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1.
点评 本题考查较为综合,涉及化学平衡常数的计算、化学平衡状态判断、盖斯定律应用、原电池原理等知识,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握化学平衡三段式在化学平衡计算中的应用,试题培养了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
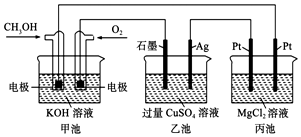
| A. | 甲池中阳离子向通入CH3OH一方的电极区域内移动 | |
| B. | 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O═CO32-+8H+ | |
| C. | 反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 | |
| D. | 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上产生1.45 g固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C≡C | H-O | C-H |
| E/(KJ.mol-1) | 436 | 343 | x | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ |
 ;元素⑨形成的氢化物的电子式
;元素⑨形成的氢化物的电子式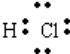 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
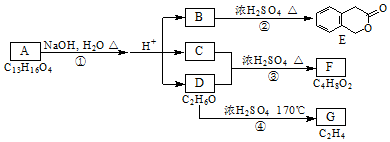
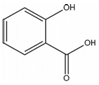 ,其名称为:邻羟基苯甲酸
,其名称为:邻羟基苯甲酸 ④反应的反应类型是消去反应
④反应的反应类型是消去反应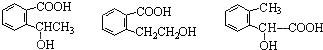 任意一个
任意一个 或CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH.
或CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
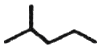 ②甲苯 ③ClCH=CHCl ④
②甲苯 ③ClCH=CHCl ④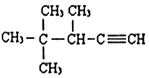
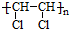
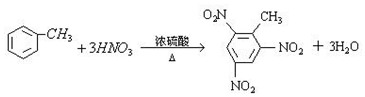 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com