
| A. | Fe | B. | Cu | C. | 氯水 | D. | KSCN溶液 |
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物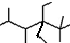 (键线式结构)的名称是2,3,5,5-四甲基-4,4-二乙基己烷 (键线式结构)的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 环己烯与化合物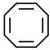 (键线式结构)互为同系物 (键线式结构)互为同系物 | |
| C. | 分子式为C4H8O2的有机物在酸性条件下可水解为酸和醇,若将所有可能得到的醇和酸重新酯化,可形成的酯共有16种 | |
| D. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 试管、蒸发皿既能用于给固体加热也能用于给溶液加热 | |
| B. | 分液漏斗既能用于某些混合物的分离也能用于组装气体发生装置 | |
| C. | 碱式滴定管既可用于中和滴定,也可用于量取一定量的NaCl或AlCl3溶液 | |
| D. | 测量酒精沸点的实验中,应使温度计水银球位于被加热的酒精中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
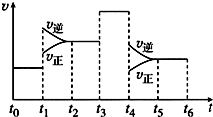 300℃下,将2mol SO21mol O2混合于2L的恒容密闭容器中,发生反应:2SO2(g)+O2(g)?2SO3(g)△H,2分钟末达到平衡,测得SO2的转化率为60%,请根据化学反应的有关原理回答下列问题:
300℃下,将2mol SO21mol O2混合于2L的恒容密闭容器中,发生反应:2SO2(g)+O2(g)?2SO3(g)△H,2分钟末达到平衡,测得SO2的转化率为60%,请根据化学反应的有关原理回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
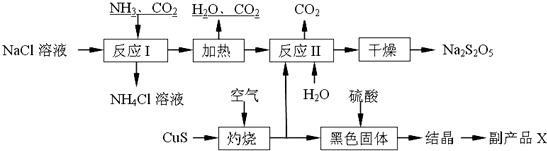
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
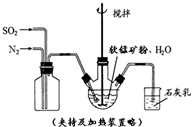 高纯MnCO3是制备高性能磁性材料的主要原料.某化学小组在实验室模拟用软锰矿(主要成分MnO2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
高纯MnCO3是制备高性能磁性材料的主要原料.某化学小组在实验室模拟用软锰矿(主要成分MnO2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
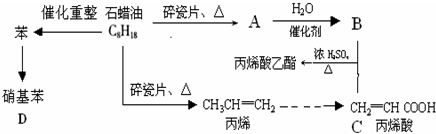
 A→B的反应类型:加成反应
A→B的反应类型:加成反应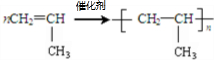 ;
;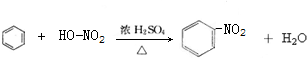 ,
,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com