
【题目】下列各图为几种晶体或晶胞的构型示意图。


请回答下列问题:
(1)这些晶体中,粒子之间以共价键结合形成的晶体是_______________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为_________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能________(填“大于”或“小于”)MgO晶体的晶格能,原因是__________________________。
(4)每个Cu晶胞中实际占有________个Cu原子,CaCl2晶体中Ca2+的配位数为________。
(5)冰的熔点远高于干冰的重要原因是__________________。
【答案】金刚石晶体 金刚石>MgO>CaCl2>冰>干冰 小于 在MgO、NaCl晶体中,离子半径:r(Mg2+)<r(Na+)、r(O2-)<r(Cl-),且MgO晶体中离子的电荷数大于NaCl晶体中离子电荷数 4 8 H2O分子之间存在氢键
【解析】
(1)先判断各种晶体类型,然后判断微粒之间的作用力是否属于共价键;
(2)结合各类晶体的构成微粒的作用力大小判断物质的熔点高低顺序;
(3)离子电荷越多、半径越小,晶格能越大;
(4)Cu原子位于晶胞的顶点和面心上,Ca2+位于晶胞的面心与顶点,利用均摊法计算;CaCl2晶体中Cl-的配位数为4,由化学式可知CaCl2晶体中Ca2+的配位数为Cl-的配位数的2倍;
(5)冰中水分子间形成氢键,冰的熔点远高于干冰。
(1)冰、干冰晶体属于分子晶体,构成微粒属于分子,分子之间以分子间作用力结合,不符合题意;金刚石属于原子晶体,原子之间以共价键结合,符合题意;Cu属于金属晶体,金属阳离子与自由电子之间以金属键结合,不符合题意;MgO、CaCl2属于离子晶体,离子之间以离子键结合,不符合题意;故这些晶体中,粒子之间以共价键结合形成的晶体是金刚石晶体;
(2)一般情况下,微粒的作用力:原子晶体>离子晶体>分子晶体。在上述物质中,金刚石属于原子晶体,熔沸点最高;MgO、CaCl2属于离子晶体,熔沸点比金刚石的低,由于离子半径Mg2+比Ca2+的小,O2-比Cl-的小,离子半径越小,离子键越强,断裂消耗的能量就越大,物质的熔点就越高,所以熔点:MgO>CaCl2;冰、干冰都属于分子晶体,分子之间以分子间作用力结合,由于H2O分子之间存在氢键,CO2分子之间只存在分子间作用力,所以熔点冰>干冰,故上述五种物质中熔点由高到低的顺序为:金刚石>MgO>CaCl2>冰>干冰;
(3) 在MgO、NaCl晶体中,离子半径:r(Mg2+)<r(Na+)、r(O2-)<r(Cl-),且MgO晶体中离子的电荷数大于NaCl晶体中离子电荷数,所以晶格能MgO比NaCl的大;
(4)Cu晶胞属于面心立方结构,每个晶胞中含有的Cu原子个数为8×![]() +6×
+6×![]() =4;
=4;
Ca2+位于晶胞的面心与顶点,每个CaCl2晶胞中实际占有Ca2+ 离子数目为8×![]() +6×
+6×![]() =4,CaCl2晶体中Cl-周围有4个距离相等且最近的Ca2+,所以Cl-的配位数为4,由化学式可知CaCl2晶体中Ca2+的配位数为Cl-的配位数的2倍,则Ca2+的配位数为8;
=4,CaCl2晶体中Cl-周围有4个距离相等且最近的Ca2+,所以Cl-的配位数为4,由化学式可知CaCl2晶体中Ca2+的配位数为Cl-的配位数的2倍,则Ca2+的配位数为8;
(5)冰、干冰都是分子晶体,分子之间以分子间作用力结合,由于冰中水分子间形成了氢键,使冰的熔点远高于干冰的熔点。


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行如下实验探究。
实验一:测定硫元素的含量
I.将m1 g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全,得到红棕色固体和一种刺激性气味的气体。
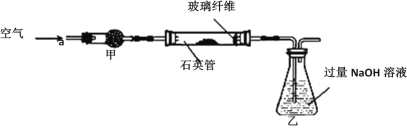
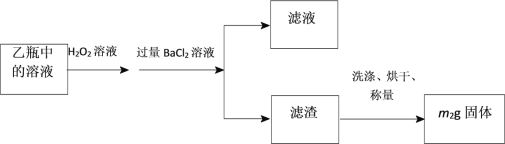
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:
问题与讨论:
(1)石英管中发生反应的化学方程式为_________。
(2)I中,干燥管甲内所盛试剂是________,石英管中的玻璃纤维的作用为__________。
(3)该黄铁矿石中硫元素的质量分数为___________。
实验二:测定铁元素的含量

问题与讨论:
(4)步骤②中,若选用铁粉作还原剂,会使测量结果________(填“不影响”、“偏高”或“偏低”)。
(5)步骤③中,需要用到的玻璃仪器有烧杯、玻璃棒、_______、________。
(6)滴定终点的现象是___。
(7)用c mol/LKMnO4溶液滴定,终点时消耗KMnO4溶液V mL,则黄铁矿中铁元素的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的性质是了解工农业生产的重要基础。NA为阿伏伽德罗常数的值,下列有关说法错误的是
A.22.4 L(标准状况)15NH3含有的质子数为10 NA
B.密闭容器中,2 mol NO与1 mol O2充分反应,产物的分子数为2 NA
C.13.8 g NO2与足量水反应,转移的电子数为0.2 NA
D.常温下,1 L 0.1 mol·L1 NH4NO3溶液中含有的氮原子数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是( )


A.用乙醇萃取碘水中的碘B.用装置甲制取纯净的![]()
C.用装置乙除去![]() 中的少量
中的少量![]() D.中和滴定时,用待测液润洗锥形瓶,减小实验误差
D.中和滴定时,用待测液润洗锥形瓶,减小实验误差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,![]() ,
,![]() 。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A.![]() 的
的![]() 溶液:
溶液:![]()
B.![]() 的
的![]() 溶液和
溶液和![]() 的
的![]() 溶液混合
溶液混合![]() :
:![]()
C.![]() 的
的![]() 溶液和
溶液和![]() 的
的![]() 溶液等体积混合:
溶液等体积混合:![]()
D.![]() 的
的![]() 溶液和
溶液和![]() 的
的![]() 溶液等体积混合:
溶液等体积混合:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有几组物质的熔点(℃)的数据:
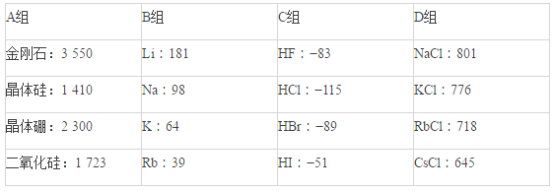
据此回答下列问题:
(1)A组属于___________晶体,其熔化时克服的微粒间的作用力是__________________。
(2)B组晶体共同的物理性质是___________________(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于_______________________________________。
(4)D组晶体可能具有的性质是_________________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因解释为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标明下列反应电子转移情况,并根据要求回答问题。
(1)3NO2+H2O=2HNO3+NO_______
(2)氧化剂____________还原剂____________氧化产物____________还原产物__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚苯胺是一种在充放电过程中具有更优异可逆性的电极材料。Zn一聚苯胺二次电池的结构示意图如图所示,设NA为阿伏加德罗常数的值。下列说法错误的是( )
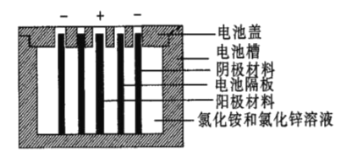
A.放电时,外电路每通过0.1NA个电子时,锌片的质量减少3.25g
B.充电时,聚苯胺电极的电势低于锌片的电势
C.放电时,混合液中的Cl-向负极移动
D.充电时,聚苯胺电极接电源的正极,发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置,在仪器①②③中分别依次加入下列各选项中所对应的试剂进行实验,能达到实验目的的是

A. 浓盐酸、浓硫酸、浓硫酸,制取干燥的氯化氢气体
B. 浓盐酸、二氧化锰、饱和食盐水,制取纯浄的氯气
C. 稀硫酸、溶液X、澄清石灰水,检验溶液X中是否含有CO32—
D. 浓盐酸、碳酸钙、水玻璃,验证盐酸、碳酸、硅酸的酸性强弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com