
【题目】研究氮氧化物的反应机理,对于消除对环境的污染有重要意义。升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)![]() 2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)
2NO2(g)的速率却随着温度的升高而减小。某化学小组为研究该特殊现象的实质原因,查阅资料知2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快);v1正=k1正c2(NO);v1逆=k1逆c(N2O2)H1<0
N2O2(g)(快);v1正=k1正c2(NO);v1逆=k1逆c(N2O2)H1<0
②N2O2(g)+O2(g)![]() 2NO2(g)(慢);v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)H2<0
2NO2(g)(慢);v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)H2<0
请回答下列问题:
(1)反应2NO(g)+O2(g)![]() 2NO2(g)的H= (用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的H= (用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)决定2NO(g)+O2(g)![]() 2NO2(g)速率的是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1 E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是 。
2NO2(g)速率的是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1 E2(填“>”、“<”或“=”)。根据速率方程分析,升高温度该反应速率减小的原因是 。
A.k2正增大,c(N2O2)增大
B.k2正减小,c(N2O2)减小
C.k2正增大,c(N2O2)减小
D.k2正减小,c(N2O2)增大
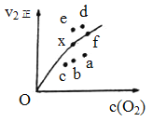
由实验数据得到v2正~[O2]的关系可用右图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为 (填字母)。
(3)工业上可用氨水作为NO2的吸收剂,NO2通入氨水发生的反应:2NO2+2NH3·H2O=NH4NO3+NH4NO2+H2O。若反应后的溶液滴入甲基橙呈红色,则反应后溶液中c(NH4+) c(NO3-)+c(NO2-)(填“>”“<”或“=”)。工业上也可用电解法处理氮氧化物的污染。电解池如图所示,阴阳电极间是新型固体氧化物陶瓷,在一定条件下可传导O2-。
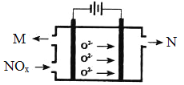
该电解池阴极的电极反应式是 。阳极产生的气体N的化学式是 。
【答案】
(1)△H1+△H2;![]() ;减小;
;减小;
(2)<;c;a;
(3)<;2NOx+4xe-=N2+2xO2-;O2。
【解析】
试题分析:(1)①2NO(g)![]() N2O2(g);②N2O2(g)+O2(g)
N2O2(g);②N2O2(g)+O2(g)![]() 2NO2(g),而目标反应2NO(g)+O2(g)2NO2(g)的△H=①+②=△H1+△H2,由反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆,即k1正c2(NO)×k2正c(N2O2)c(O2)=k1逆c(N2O2)×k2逆c2(NO2),则是K=
2NO2(g),而目标反应2NO(g)+O2(g)2NO2(g)的△H=①+②=△H1+△H2,由反应达平衡状态,所以v1正=v1逆、v2正=v2逆,所以v1正×v2正=v1逆×v2逆,即k1正c2(NO)×k2正c(N2O2)c(O2)=k1逆c(N2O2)×k2逆c2(NO2),则是K=![]() =
=![]() ,而正反应是放热反应,所以升高温度,平衡常数减小,故答案为:△H1+△H2;
,而正反应是放热反应,所以升高温度,平衡常数减小,故答案为:△H1+△H2;![]() ;减小;
;减小;
(2)因为决定2NO(g)+O2(g)![]() 2NO2(g)速率的是反应②,所以反应①的活化能E1远小于反应②的活化能E2;决定反应速率的是反应②,而温度越高k2正增大,反应速率加快,二氧化二氮的浓度减少,导致两者的积减小;v2正升高到某一温度时v2正减小,平衡逆向移动,氧气的浓度增大,所以反应重新达到平衡,则变为相应的点为a,故答案为:<;c;a;
2NO2(g)速率的是反应②,所以反应①的活化能E1远小于反应②的活化能E2;决定反应速率的是反应②,而温度越高k2正增大,反应速率加快,二氧化二氮的浓度减少,导致两者的积减小;v2正升高到某一温度时v2正减小,平衡逆向移动,氧气的浓度增大,所以反应重新达到平衡,则变为相应的点为a,故答案为:<;c;a;
(3)根据电荷守恒c(NH4+)+c(H+)=c(NO3-)+c(NO2-)+c(OH-),而甲基橙呈红色,说明溶液呈酸性c(H+)>c(OH-),所以c(NH4+)<c(NO3-)+c(NO2-),O2-在阳极发生氧化反应生成氧气,所以气体N为O2,而氮的氧化物在阴极发生还原反应生成氮气,阴极的电极反应式:2NOx+4xe-=N2+2xO2-,故答案为:<;2NOx+4xe-=N2+2xO2-;O2。


科目:高中化学 来源: 题型:
【题目】一学生设计了如下实验方法分离NaCl和CaCl2两种固体混合物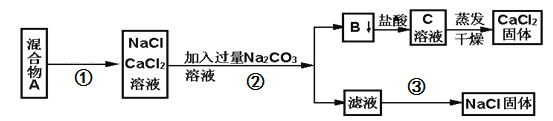
填空和回答下列问题
(1)写出操作①、②、③的名称:①________、②_________、③____________。
(2)写出B物质与盐酸反应的离子方程式______________________________。
(3)按此实验方案分离得到的NaCl,经分析含有杂质,是因为上述方案中某一步设计有缺陷,这一步的正确设计方案应是______。
(4)若要测定该样品中NaCl和CaCl2的质量比,可称量干燥的B物质和另一物质的质量,这种物质是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应属于放热反应的是( )
A. 浓硫酸溶于水 B. 镁溶于盐酸
C. 石灰石煅烧 D. Ba(OH)2·8H2O晶体与NH4Cl晶体混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在pH=1的溶液中,下列离子组能大量共存且溶液为无色透明的是C
A.Na+、K+、OH-、Cl-
B.Na+、Cu2+ 、SO42-、NO3-
C.Mg2+、Na+、SO42-、Cl-
D.Ba2+、HCO3-、NO3-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO3溶液和Na2CO3溶液混合加热煮沸能产生CO2气体。下列说法中正确的是( )
A.NaHSO3溶液因水解而呈碱性
B.两溶液混合后产生CO2的原因是二者发生相互促进的水解反应
C.向NaHSO3溶液中加入三氯化铁溶液既有沉淀生成,又有气体生成
D.0.1 mol·L-1的NaHSO3溶液中:c(HSO![]() )+2c(SO
)+2c(SO![]() )+c(OH-)-c(H+)=0.1 mol·L-1
)+c(OH-)-c(H+)=0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 碳酸钠是重要化工原料,可用于制玻璃、造纸等
B. SO2可用于漂白纸浆、草帽和酸性高锰酸钾溶液
C. 溴单质只存在于海洋中,因此溴被称为“海洋元素”
D. 常温下铁遇浓硫酸不反应,因此可用铁槽车储运浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol的镁、铝混合物溶于100 mL 2 mol·L-1的H2SO4溶液中,然后再滴加1 mol·-1的NaOH溶液。请回答:

(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化的关系如图所示,当V1=160 mL时,则金属粉末中n(Mg)=______________mol,V2=_____________ mL。
(2)若混合物仍为0.1 mol,其中Mg粉物质的量分数为a ,用100 mL2mol·L-1的H2SO4溶解此混合物后,再加入450mL1mol/LNaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)为白色粉末,容易吸水潮解,可溶于异丙胺(熔点:-101℃,沸点:33℃),在干空气中稳定,在湿空气中分解,是无机合成和有机合成中常用的选择性还原剂。某研究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:

下列说法不正确的是
A.实验室中取用少量钠需要用到的实验用品有镊子、滤纸、玻璃片和小刀
B.操作②、操作③分别是过滤与蒸发结晶
C.反应①加料之前需将反应器加热至100℃以上并通入氩气
D.反应①中氧化剂与还原剂的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用标准的KOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是( )
A. 配制标准溶液的固体KOH中混有NaOH杂质
B. 滴定到终点读数时,仰视滴定管的刻度,其他操作正确
C. 盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D. 滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com