
【题目】用废易拉罐制备明矾的实验步骤如下:
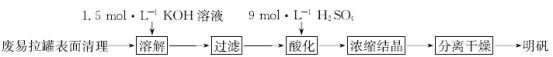
回答下列问题:
(1)清除已剪成片状的废易拉罐表面颜料及塑料内膜的方法是_________________。
(2)实验需用100 mL 1.5 mol·L-1 KOH溶液,配制时需称取KOH固体质量为_________;配制过程中需要的玻璃仪器有烧杯、量筒、玻璃棒及_____________和_____________。
(3)“溶解”时发生反应的化学方程式为________________。
(4)“酸化”时,为使硫酸滴加量不过量太多,正确的操作依据是_________。
(5)鉴定明矾中含有K+的操作方法及现象是_________。
【答案】可用砂纸打磨或灼烧 8.4g 100mL容量瓶 胶头滴管 2Al+2NaOH+2H2O=2NaA1O2+3H2↑ 滴加硫酸先生成白色沉淀,继续滴加硫酸至生成的沉淀刚好完全溶解为止 用玻璃棒蘸明矾溶液少许,在酒精灯火焰上灼烧,透过蓝色钴玻璃观察,火焰呈紫色,说明含有K+
【解析】
(1)废易拉罐表面颜料及塑料内膜可用砂纸将其强行处理,也可利用塑料的可燃性处理;
(2)配制100 mL 1.5 mol·L-1 KOH溶液时,需称取KOH固体质量为1.5 mol·L-1 ×0.1L×56g/mol;配制过程中需要的玻璃仪器有烧杯、量筒、玻璃棒及100mL容量瓶和胶头滴管;
(3)“溶解”时发生的反应是铝与氢氧化钠溶液的反应;
(4)“酸化”时,为使硫酸滴加量不过量太多,可以起初生成的沉淀刚好完全溶解为判断依据;
(5)鉴定明矾中含有K+的操作方法及现象是焰色反应、透过蓝色钴玻璃观察火焰,看是否呈紫色。
(1) 清除已剪成片状的废易拉罐表面颜料及塑料内膜的方法是可用砂纸打磨或灼烧。答案为:可用砂纸打磨或灼烧;
(2)配制100 mL 1.5 mol·L-1 KOH溶液时,需称取KOH固体质量为1.5 mol·L-1 ×0.1L
×56g/mol=8.4g;配制过程中还需使用100mL容量瓶和胶头滴管。答案为:8.4g;100mL容量瓶;胶头滴管;
(3)“溶解”时发生的反应是2Al+2NaOH+2H2O=2NaA1O2+3H2↑。答案为:2Al+2NaOH+2H2O=2NaA1O2+3H2↑;
(4)“酸化”时,为使硫酸滴加量不过量太多,正确的操作依据是滴加硫酸先生成白色沉淀,继续滴加硫酸至生成的沉淀刚好完全溶解为止。答案为:滴加硫酸先生成白色沉淀,继续滴加硫酸至生成的沉淀刚好完全溶解为止;
(5)鉴定明矾中含有K+的操作方法及现象是用玻璃棒蘸明矾溶液少许,在酒精灯火焰上灼烧,透过蓝色钴玻璃观察,火焰呈紫色,说明含有K+。答案为:用玻璃棒蘸明矾溶液少许,在酒精灯火焰上灼烧,透过蓝色钴玻璃观察,火焰呈紫色,说明含有K+。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应,X2++Z=X+Z2+,Y+Z2+=Y2++Z。这四种离子被还原成0价时,表现的氧化性强弱顺序为( )
A.R2+>X2+>Z2+>Y2+B.X2+>R2+>Y2+>Z2+
C.Y2+>Z2+>R2+>X2+D.Z2+>X2+>R2+>Y2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲基苯乙烯(![]() )是有机合成的重要原料。下列对其结构与性质的推错误的是( )
)是有机合成的重要原料。下列对其结构与性质的推错误的是( )
A. 分子式为![]()
B. 能发生加聚反应和氧化反应
C. 具有相同官能团的芳香烃同分异构体有5种![]() 不考虑立体异构
不考虑立体异构![]()
D. 分子中所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学拟用煤干馏的产物W为基本原料合成一系列化工产品,其流程如下(部分产物和条件省略):

己知部分信息如下:
①1mol芳香烃W含50mol电子;
②![]() ;
;
③![]() (苯胺,易被氧化)
(苯胺,易被氧化)
④K的分子式为C7H6O2,其核磁共振氢谱上有4个峰。
请回答下列问题:
(1)X的名称为_________,Y中所含官能团的名称为_________ 。
(2)反应⑦的条件为_________,②的反应类型________。
(3)反应⑤的化学方程式为_________。
(4)Z的结构简式为_________ 。
(5)K的同分异构体M既能发生水解反应,又能发生银镜反应,M在氢氧化钠溶液中发生水解反应的化学方程式为__________。
(6) 有多种同分异构体,写出符合以下3个条件的同分异构体的结构简式_________。
有多种同分异构体,写出符合以下3个条件的同分异构体的结构简式_________。
①能发生银镜反应但不能水解。
②每摩尔同分异构体最多消耗2molNaOH。
③苯环上一氯代物只有两种。
(7)请以流程图的形式写出由T制备 的过程(无机试剂任选):(仿照
的过程(无机试剂任选):(仿照 )_____________________
)_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式或电离方程式中,不能正确表达反应颜色变化的是
A.将氨气通入滴有酚酞试液的水中,溶液变红:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-
NH4++OH-
B.少量FeCl3溶液滴入沸水中变为红褐色液体:FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
C.向CuCl2溶液中加入足量的铁粉,溶液由蓝色变为浅绿色:Fe+CuCl2=Cu+FeCl2
D.呼吸面具使用后,Na2O2由淡黄色逐渐变为白色:2Na2O2=2Na2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是白色六方系晶体,剧毒,易溶于水,是HN3(氢叠氮酸,酸性与醋酸相似的弱酸)的钠盐。回答下列问题:
(1)实验室可用NaN3分解(生成两种单质)制备高纯N2,已知NA为阿伏加德罗常数的值,每生成1 mol N2转移电子数为___________。
(2)NaN3和稀硫酸反应制HN3的离子方程式为______________。
(3)NaNH2与N2O在210~220℃时反应可制备NaN3,同时放出能使湿润红色石蕊试纸变蓝的气体,该反应的化学方程式为_____________________。
(4)测定工业品叠氮化钠中NaN3质量分数的实验步骤如下:
(I)准确称量试样m g,另加少许NaOH于烧杯中,加入适量蒸馏水溶解,转移至250mL容量瓶中定容;
(II)准确移取配得的溶液20.00mL于锥形瓶中,慢慢加入V1 mL c1 mol·L-1(NH4)2Ce(NO3)6溶液,充分反应后,加适量水稀释,加入5 mL浓硫酸,加2滴邻罗啉指示剂,用c2 mol·L-1(NH4)2Fe(SO4)2标准溶液滴定到溶液由淡绿色变为黄红色(Ce4++Fe2+=Ce3++Fe3+),消耗标准溶液V2 mL。
①NaN3与(NH4)2Ce(NO3)6溶液反应的氧化产物为N2,还原产物为Ce(NO3)3,其离子方程式为______。
②则样品中NaN3的质量分数为__________(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
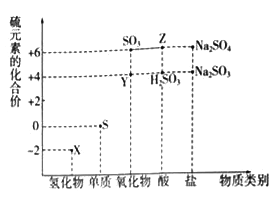
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______(填化学式)。
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为_______。
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______。
(4)Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是______(填代号)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4则24mL 0.05molL﹣1的Na2SO3溶液与 20mL 0.02molL﹣1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从物质A(某正盐)的水溶液出发有下面所示的一系列变化:

(1)写出A~F物质的化学式:
A__________;B__________;C__________;D__________;E.__________;F__________。
(2)写出E→F的化学方程式______________________________。
(3)鉴别物质F中阴离子的方法是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
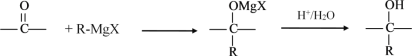
【题目】格氏试剂在有机合成方面用途广泛,可用卤代烃和镁在醚类溶剂中反应制得。
设R为烃基,已知RX +Mg![]() R-MgX(格氏试剂)
R-MgX(格氏试剂)
阅读以下合成路线图,回答有关问题:

(1)反应I的类型是____________,反应II的条件是____________。
(2)反应III的化学方程式为____________。
(3)E的同分异构体中,含有苯环且能发生银镜反应的有机物共有____________种。
(4)有机物![]() 是合成药物中的一种原料,实验室可用下列合成路线合成该有机物:
是合成药物中的一种原料,实验室可用下列合成路线合成该有机物:
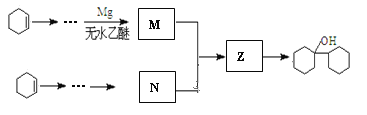
其中Z的结构简式为____________,用反应流程图表示以环己烯(![]() )为有机原料合成有机物N。____________
)为有机原料合成有机物N。____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com