
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
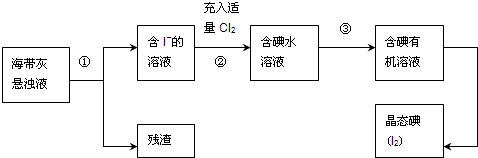
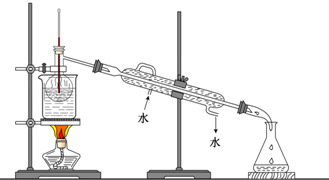
查看答案和解析>>
科目:高中化学 来源: 题型:
甲:将反应所得的ZnI2和I2的混合物,加蒸馏水溶解,再加四氯化碳萃取碘单质,用分液漏斗分出下层的四氯化碳层,经蒸馏回收四氯化碳,可得碘单质;分液漏斗上层水层,从上口倒入蒸发皿内蒸发,可得碘化锌。
乙:将反应所得ZnI2和I2的混合物,小心加热使其中水分蒸发;然后将一盛有冷水的烧瓶置于烧杯口上,继续用酒精灯加热,使碘升华并在烧瓶底部凝华,碘化锌仍留在烧杯中。
试写出Zn和I2反应生成碘化锌的化学方程式,简析甲、乙两种分离方案哪种可行,哪种不可行,还是两种都可行。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com