
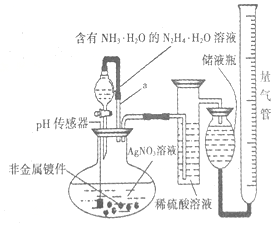
 化学镀银法是非金属表面镀银的常用方法,如图是研究化学镀银中银元素利用率的实验装置(夹持仪器略):
化学镀银法是非金属表面镀银的常用方法,如图是研究化学镀银中银元素利用率的实验装置(夹持仪器略): .已知稀硝酸的氧化性强于Ag+,NH3•H2O中加适量氨水的一个重要目的是控制溶液的pH在8-9之间,简述溶液不能呈酸性的理由如果溶液呈酸性,被还原的是HNO3,而得不到银单质,从而导致实验失败.
.已知稀硝酸的氧化性强于Ag+,NH3•H2O中加适量氨水的一个重要目的是控制溶液的pH在8-9之间,简述溶液不能呈酸性的理由如果溶液呈酸性,被还原的是HNO3,而得不到银单质,从而导致实验失败.分析 (1)N2H4是共价化合物,其电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况;稀硝酸的氧化性强于Ag+,NH3•H2O中加适量氨水的一个重要目的是控制溶液的pH在8-9之间,若呈酸性,被还原的是硝酸,得不到金属银,从而导致实验失败,因此控制溶液的pH在8-9之间;
(2)恒压漏斗液面上方气体压强与烧瓶中气体的压强相同,可以使漏斗中液体顺利流下,也能减小因加入液体体积对测定气体体积造成误差;
(3)在N2H4•H2O中加入适量氨水,可以与Ag+反应,降低任由中Ag+浓度,以达到降低反应速率的目的,使银膜更加均匀致密;
(4)200mL 0.l00ml/L AgNO3溶液中溶质硝酸银物质的量=0.20L×0.100mol/L=0.02mol,非金属镀件镀前镀后质量差为银的质量,m(Ag)=21.728 g-20.000g=1.728g,物质的量n(Ag)=$\frac{1.728g}{108g/mol}$=0.016mol,收集到的氮气的物质的量=$\frac{0.1064L}{22.4L/mol}$=0.00475mol,因此反应的银离子总量为0.00475mol×4=0.19mol,据此计算非还原损耗,还原损耗;
(5)化学镀银中常用次磷酸钠(NaH2PO2)做还原剂,已知该反应的氧化产物为磷酸,结合电子守恒、原子守恒和电荷守恒配平书写离子方程式.
解答 解:(1)肼是氮原子和氮原子形成一个共价键,剩余价键和氢原子形成共价键,电子式为
故答案为:
(2)带有导管a的分液漏斗叫恒压漏斗,恒压漏斗液面上方气体压强与烧瓶中气体的压强相同,保持内外压强相平可以使漏斗中液体顺利流下,也能减小因加入液体体积对测定气体体积造成误差,故选BC,
故答案为:BC;
(3)银膜是否均匀致密的关键在于“沉银”速率控制,一般速率越慢,银膜越均匀越致密,在N2H4•H2O中加入适量氨水,可以与Ag+反应,降低任由中Ag+浓度,以达到降低反应速率的目的,使银膜更加均匀致密,加入氨水的另外一个目的是:与Ag+反应降低任由中Ag+浓度,以达到降低反应速率的目的,
故答案为:与Ag+反应降低任由中Ag+浓度,以达到降低反应速率的目的;
(4)200mL 0.l00ml/L AgNO3溶液中溶质硝酸银物质的量=0.20L×0.100mol/L=0.02mol,非金属镀件镀前镀后质量差为银的质量,m(Ag)=21.728 g-20.000g=1.728g,物质的量n(Ag)=$\frac{1.728g}{108g/mol}$=0.016mol,收集到的氮气的物质的量=$\frac{0.1064L}{22.4L/mol}$=0.00475mol,因此反应的银离子总量为0.00475mol×4=0.19mol,则ω1=$\frac{0.2mol-0.19mol}{0.2mol}$×100%=5%,$\frac{0.19mol-0.16mol}{0.2mol}$×100%=15%,
故答案为:5%;15%;
(5)化学镀银中常用次磷酸钠(NaH2PO2)做还原剂,已知该反应的氧化产物为磷酸,反应的离子方程式为:H2PO2-+4Ag++2H2O=4Ag↓+3H++H3PO4,
故答案为:H2PO2-+4Ag++2H2O=4Ag↓+3H++H3PO4.
点评 本题考查了物质含量测定实验方案设计,题目难度中等,理解测定的原理是解题关键,注意(5)计算要正确理解非还原损耗和还原损耗的概念.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | 能与乙醇发生酯化反应 | |
| B. | 能使酸性高锰酸钾溶液褪色 | |
| C. | 能与溴的四氯化碳溶液发生取代反应 | |
| D. | 1molM与足量Na完全反应能生成1molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl- CO32- NO3- SO42- SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴趣小组对其组成进行探究.完成下列空格.
某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某化学兴趣小组对其组成进行探究.完成下列空格.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-+H2O?CO32-+H3O+ | B. | HCO3-+OH-?CO32-+H2O | ||
| C. | HCO3-+H2O?H2CO3+OH- | D. | S2-+2H2O?H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 都能作干燥剂 | B. | 都具有一定的氧化性 | ||
| C. | 加热时都能与铜发生反应 | D. | 在常温下都能用铁制容器贮存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Cl-、PO43-、Na+ | B. | H+、Fe2+、SO42-、NO${\;}_{3}^{-}$ | ||
| C. | K+、H+、NO${\;}_{3}^{-}$、Na+ | D. | OH-、Br-、SO42-、NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com