
| A. | 硅单质可用来制造太阳能电池 | |
| B. | 装碱性溶液的玻璃试剂瓶不能用玻璃塞 | |
| C. | 二氧化硅是制造光导纤维的材料 | |
| D. | 自然界硅元素的贮量丰富,并存在大量的单质硅 |
分析 A.Si可作半导体材料;
B.玻璃塞中二氧化硅与碱反应生成具有粘合性的硅酸钠;
C.二氧化硅具有对光良好的全反射作用;
D.Si为亲氧元素.
解答 解:A.Si可作半导体材料,则硅单质可用来制造太阳能电池,故A正确;
B.玻璃塞中二氧化硅与碱反应生成具有粘合性的硅酸钠,则装碱性溶液的玻璃试剂瓶不能用玻璃塞,故B正确;
C.二氧化硅具有对光良好的全反射作用,则二氧化硅是制造光导纤维的材料,故C正确;
D.Si为亲氧元素,则自然界硅元素的贮量丰富,主要以化合态存在,故D错误;
故选D.
点评 本题考查硅与二氧化硅,为高频考点,把握物质的性质、性质与用途为解答的关键,侧重分析与应用能力的考查,注意Si为亲氧元素,题目难度不大.


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:实验题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合溶液中c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) | |
| B. | 混合溶液中c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) | |
| C. | 加入AgNO3溶液时首先生成AgCl沉淀 | |
| D. | 混合溶液中$\frac{c(C{l}^{-})}{c({I}^{-})}$约为1.03×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
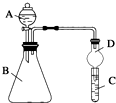 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
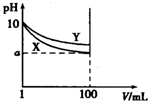 常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )| A. | X、Y两种碱溶液中溶质的物质的量浓度一定相等 | |
| B. | 稀释后,X溶液的碱性比Y溶液的碱性强 | |
| C. | 分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸 的体积Vx>Vy | |
| D. | 若8<a<10,则X、Y都是弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
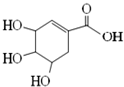
| A. | 分子式为C7H8O5 | |
| B. | 分子中含有2种官能团,可发生加成、酯化反应 | |
| C. | 其同分异构体中可能含酯基和醛基,不可能含有苯环 | |
| D. | 该化合物与足量的 Na、NaOH反应得到的钠盐产物相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com