
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(s)+2B(g)![]() C(g)+D(g)已达到平衡状态( )
C(g)+D(g)已达到平衡状态( )
①混合气体的压强 ②混合气体的密度 ③ B的物质的量浓度 ④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧C、D的分子数之比为1∶1
A. ②③④⑤ B. ①③⑤⑦ C. ②③⑤⑦ D. ②③⑤⑥
【答案】C
【解析】①、该反应为气体体积不变的反应,压强为不变量,所以混合气体的压强不变时,不能说明该反应达到平衡状态,故①错误;
②、该反应中A物质是固体,容器容积不变,混合气体总质量为可变量,则密度也为可变量,所以密度不变时,可以说明反应达到平衡状态,故②正确;
③、B的物质的量浓度不变时,说明正逆反应速率相等,该反应达到平衡状态,故③正确;
④、该反应为气体体积不变的反应,则混合气体的总物质的量为不变量,当混合气体的总物质的量不变时,不能说明该反应达到平衡状态,故④错误;
⑤、根据方程式可知,混合气体的总质量为可变量,总物质的量为不变量,则混合气体的平均相对分子质量为可变量,当混合气体的平均相对分子质量不变时,说明各组分的浓度不再变化,达到平衡状态,故⑤正确;
⑥、虽然v(C)与v(D)的比值不变,但由于未说明二者表示的是正速率还是逆速率,则无法判断平衡状态,故⑥错误;
⑦、该反应中A物质是固体,则混合气体的总质量是可变量,所以混合气体的总质量不变,说明反应达到了平衡状态,故⑦正确;
⑧、C. D的分子数之比为1:1,无法判断各组分的浓度是否不再变化,则无法判断平衡状态,故⑧错误;
所以此题符合题意的是:②③⑤⑦,故答案选C。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 分子式为![]() 的链状烃共有(考虑顺反异构体)
的链状烃共有(考虑顺反异构体)![]() 种
种
B. 分子式为![]() 属于芳香化合物的同分异构体有
属于芳香化合物的同分异构体有![]() 种
种
C. 正丁烷的二氯代物有![]() 种
种
D. 分子式为![]() 属于醇类的同分异构体有
属于醇类的同分异构体有![]() 种
种
查看答案和解析>>
科目:高中化学 来源: 题型:
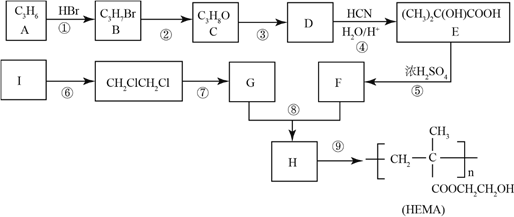
【题目】以高分子化合物聚甲基丙稀酸羟乙基酯(![]() )为材料,可制成软性隐形眼镜。其合成路线图如下:
)为材料,可制成软性隐形眼镜。其合成路线图如下:
已知:![]() 的核磁共振氢谱有三个峰,且峰面积之比为
的核磁共振氢谱有三个峰,且峰面积之比为![]()
i i ![]() 与
与![]() 互为同系物
互为同系物
i i i i ![]()
回答以下问题:
(1)![]() 的官能团的名称是_________。
的官能团的名称是_________。
(2)反应①至⑨的反应中属于加成反应的有_________,属于消去反应的有_________。(填序号)
(3)下列说法正确的是(选填字母)_________。
![]() .
.![]() 具有顺反异构现象
具有顺反异构现象 ![]() .
.![]() 不可以使酸性高锰酸钾褪色
不可以使酸性高锰酸钾褪色
![]() .反应②、⑦和⑧都属于取代反应
.反应②、⑦和⑧都属于取代反应 ![]() .反应②和⑦所用试剂和反应条件相同
.反应②和⑦所用试剂和反应条件相同
![]() .
.![]() 的核磁共振氢谱有三种峰,其峰面积之比额
的核磁共振氢谱有三种峰,其峰面积之比额![]()
(4)写出下列反应的化学方程式或反应类型:
反应③____________________________________反应类型_______________;
反应⑦________________________________________________________________________;
反应⑧________________________________________________________________________;
(5)![]() 可以与氢气发生加成反应,加成后的产物有多种同分异构体,其中含
可以与氢气发生加成反应,加成后的产物有多种同分异构体,其中含![]() 和
和![]() 可能的结构共有_________种,写出其中带有支链的同分异构体的结构简式__________________。
可能的结构共有_________种,写出其中带有支链的同分异构体的结构简式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)===2H2O(l)ΔH=-571.6kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890kJ·mol-1
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695kJ,则原混合气体中H2与CH4的物质的量之比是( )
A. 1∶1 B. 1∶3 C. 1∶4 D. 2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl﹣KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( ) 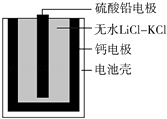
A.正极反应式:Ca+2Cl﹣﹣2e﹣═CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1 mol电子,理论上生成20.7 g Pb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气用途广泛,但在使用时,一般会产生氯化氢。工业上可用O2将HCl转化为Cl2,以提高效益,减少污染。反应为:O2(g)+4HCl(g) ![]() 2Cl2(g)+2H2O(g)
2Cl2(g)+2H2O(g)
完成下列填空:
(1)实验测得P0压强下,HCl平衡转化率α(HCl)随反应温度T的变化如图1所示,则正反应是____________反应(填“吸热”或者“放热”)。
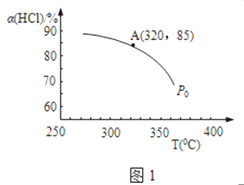
(2)该反应在P0、320°C条件下进行,达平衡状态A时,测得容器内n(Cl2)=7.2×10-3mol,则此时容器中的n(HCl) =_____________mol。
(3)对该反应达到平衡后,以下分析正确的是____________________(选填编号)。
a.增加n(HCl),对正反应的反应速率影响更大
b.体积不变加入稀有气体,对正反应的反应速率影响更大
c.压强不变加入稀有气体,对逆反应的反应速率影响更大
d.如果平衡常数K值增大,对逆反应的速率影响更大
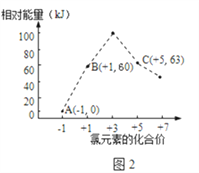
(4)氯元素能形成多种离子.在水溶液中1molCl-、1mol ClOx-(x=1,2,3,4)能量的相对大小如图2所示,写出B→A+C反应的热化学方程式(用离子符号表示)____________________;若有1.5molB发生反应,转移电子______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中,正确的是
A. K2SO4=2K++SO4-2 B. Ba(OH)2=Ba2++OH2-
C. Mg(NO3)2=Mg2++2(NO3)2- D. Fe2(SO4)3=2Fe3++3SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com