
| A. | 高铁酸钾(K2FeO4)是一种新型高效、多功能水处理剂,既能杀菌消毒又能净水 | |
| B. | “光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关 | |
| C. | 用SO2漂白纸浆和草帽辫,该过程利用了SO2的氧化性 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
分析 A.K2FeO4中Fe元素化合价高,具有强氧化性,可以杀菌消毒,被还原为铁离子,铁离子水解生成氢氧化铁胶体,表面积很大,可以吸附悬浮物起净水作用;
B.依据“光化学烟雾“、“臭氧空洞的形成的原因分析;
C.SO2漂白纸浆和草帽辫,发生化合反应生成无色物质;
D.光导纤维的主要成分是二氧化硅以及二氧化硅能与氢氧化钠溶液反应,生成硅酸钠和水.
解答 解:A.K2FeO4中Fe元素化合价高,具有强氧化性,可以杀菌消毒,被还原为铁离子,铁离子水解生成氢氧化铁胶体,表面积很大,可以吸附悬浮物起净水作用,故A正确;
B光化学烟雾的形成主要是汽车尾气排放出的氮氧化物发生复杂的变化造成的,臭氧空洞指的是因空气污染物质,特别是氮氧化物和卤化代烃等气溶胶污染物的扩散、侵蚀而造成的气臭氧层被破坏和减少的现象,故B正确;
C.SO2漂白纸浆和草帽辫,发生化合反应生成无色物质,无元素的化合价变化,为非氧化还原反应,故C错误;
D.二氧化硅能用于制光导纤维、二氧化硅能与氢氧化钠溶液反应,生成硅酸钠和水,所以光导纤维遇强碱会“断路”,故D正确;
故选:C.
点评 本题考查了生产生活中常见的污染与治理问题、二氧化硫的漂白性、硅与二氧化硅的用途等,明确相关物质的性质是解题关键,难度不大.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③②① | C. | ②③① | D. | ③①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与盐酸反应最剧烈,产生的氢气最多 | |
| B. | 铝与盐酸反应的速率仅次于钠,产生的气体也没有钠与盐酸反应产生气体多 | |
| C. | 铁与盐酸反应产生的气体比铝与盐酸反应产生的气体多 | |
| D. | 铝与盐酸反应和铁与盐酸反应产生的气体一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在10-5:10-7m之间 | |
| B. | 光线透过胶体时,胶体中可发生丁达尔效应 | |
| C. | Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的 | |
| D. | 用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
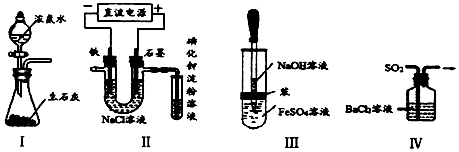
| A. | 实验Ⅰ:所示装置可制备氨气 | |
| B. | 实验Ⅱ:检验电解饱和食盐水的产物C12 | |
| C. | 实验Ⅲ:制取并观察Fe(OH)2沉淀 | |
| D. | 实验Ⅳ:吸收SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
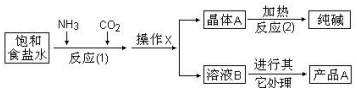
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com