
【题目】过量的SO2通入下列溶液中,不可能产生沉淀的是( )
A. 氯化钡和氯化铁的混合液 B. 氢氧化钙溶液
C. 硫化氢溶液 D. 硅酸钠溶液
科目:高中化学 来源: 题型:
【题目】(1)①Na2CO3俗称纯碱,其水溶液呈碱性,原因是________________________(用离子方程式解释);
②常温下,0.050 0 mol/L硫酸溶液的pH=__________;
③用0.010 0 mol/L氢氧化钠溶液滴定未知浓度的盐酸,酚酞作指示剂,滴定终点时,溶液的颜色由无色变为__________(填“蓝色”或“浅红色”),且半分钟内保持不变。
(2)①已知H2与O2反应生成1 mol H2O(g)时放出241.8 kJ的热量,请完成该反应的热化学方程式:2H2(g)+O2(g)===2H2O(g) ΔH=__________kJ/mol;
②已知:C(石墨,s)===C(金刚石,s) ΔH>0,则稳定性石墨比金刚石________(填“强”或“弱”)。
(3)在某恒容密闭容器中进行可逆反应FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH>0,平衡常数表达式为K=![]() 。
。
①反应达到平衡后,向容器中通入CO,化学平衡向__________(填“正反应”或“逆反应”)方向移动;
②若降低温度,平衡常数K__________(填“增大”“减小”或“不变”);
③查阅资料得知1 100 ℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,此时刻反应__________(填“达到”或“未达到”)平衡状态。
(4)电化学是研究化学能与电能相互转化的装置、过程和效率的科学。
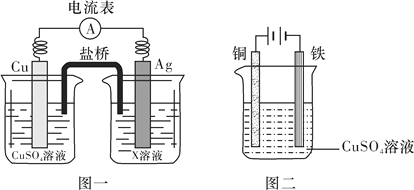
①根据氧化还原反应2Ag+(aq)+Cu(s)===2Ag(s)+Cu2+(aq),设计的原电池如图一所示,X溶液是__________(填“CuSO4”或“AgNO3”)溶液;
②图二装置在铁件上镀铜,铁作阴极,则阴极上的电极反应式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如下所示化合物的说法不正确的是( )

A. 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B. 1mol该化合物最多可以与3molNaOH反应
C. 既可以催化加氢,又可以使酸性KMnO4溶液褪色
D. 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表达下列反应的离子方程式为
A. 用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
B. 硫化亚铁与浓硫酸混合加热:2H++FeS=H2S↑+ Fe2+
C. 向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3![]() =Al2(CO3)3↓
=Al2(CO3)3↓
D. 用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH-=![]() +
+![]() + H2O
+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校甲、乙两个化学小组学生利用下图所示装置进行“铁与水反应及相关性质”的实验。
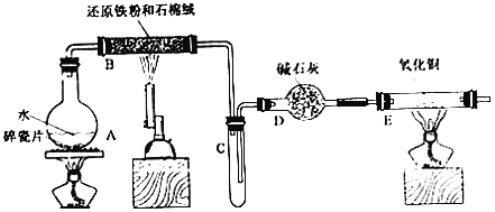
(1)装置B中发生反应的化学方程式是____________________________________。
(2)装置E中的现象是___________________________________________________。
(3)将探究小组分为两组,按题图装置进行对比实验,甲组用洒精喷灯、乙组用洒精灯加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,无气泡 |
2 | 取少骤1中溶液,滴加酸性KMnO4溶液 | 紫色褪去 | 紫色褪去 |
3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
①乙组得到的黑色粉末是________________________。
②甲组步骤1中反应的离子方程式为______________________________________。
③乙组步骤4中,溶液变红的原因为____________________、___________________;(用离子方程式表示);溶液褪色可能的原因是_____________________________;验证方法为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
A. KClO3发生还原反应
B. H2C2O4在反应中被氧化
C. H2C2O4的氧化性强于C1O2的氧化性
D. 每1mol C1O2生成,该反应转移的电子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如图所示装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。

(1)试管中发生反应的化学方程式为_______________________________。
(2)该同学欲确定反应一段时间后试管中固体物质的成分,设计了如下方案:
①待试管冷却,取其中固体少许溶于稀盐酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红,则试管中固体是________(只有一个选项符合题意),若溶液未变红,则试管中固体是________(只有一个选项符合题意)。
A.一定有Fe3O4,可能有Fe
B.只有Fe(OH)3
C.一定有Fe3O4和Fe
D.一定有Fe(OH)3,可能有Fe
E.只有Fe3O4
(3)该同学按上述方案进行了实验,溶液未变红色,原因是: __________________________(用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按右图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关反应的化学方程式__________________________________________________,______________________________________。

(5)一段时间后,该同学发现(3)中未变红的溶液变成红色。由此可知,实验室FeCl2溶液需现用现配的原因是___________________________________,并且配制时应加入少量________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二胺(H2NCH2CH2NH2 )是二元弱碱,在水中的电离原理类似于氨。常温下,向乙二胺溶液中滴加稀盐酸,溶液的pH随离子浓度变化关系如图所示。下列叙述不正确的是
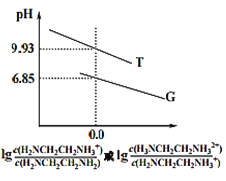
A. Kb2[H2NCH2CH2NH2] 的数量级为10-8
B. 曲线G代表pH 与![]() 的变化关系
的变化关系
C. H3NCH2CH2NH2Cl溶液中c(H+)>c(OH-)
D. 0.01mol·L-1H2NCH2CH2NH2 电离度约为10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家正在研究温室气体CH4和CO2的转化和利用。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为______。
(2)下列关于CH4和CO2的说法正确的是______(填序号)。
a.固态CO2属于分子晶体
b. CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2。
①基态Ni原子的电子排布式为____________,Ni该元素位于元素周期表的第___族。
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有_____molσ键。
(4)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”。
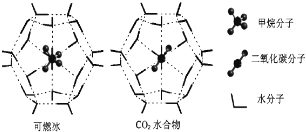
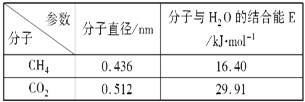
①“可燃冰”中分子间存在的2种作用力是______。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com